九州大学(九大)は、視床下部、副腎や血管などの受容体を介して、血圧調節や体内ナトリウムイオン(Na+)濃度バランスの恒常性維持の鍵ホルモンとして知られている「アンジオテンシンII」が末梢の味覚器にも働き、塩味感受性を変化させてNa+の摂取量を調節することや、さらに甘味感受性にも影響し糖分摂取にも関わることを明らかにしたと発表した。
成果は、九大大学院 歯学研究院 口腔機能解析学分野の二ノ宮裕三 主幹教授、同・重村憲徳 准教授らの研究チームによるもの。研究の詳細な内容は、米国東部時間4月9日付けで「The Journal of Neuroscience」オンライン版に掲載された。
体内のNa+濃度は体液浸透圧の保持、神経の興奮など生命維持に不可欠な働きを担うため、常に一定に保たれる必要がある。例えば、体液中のNa+が減少すると、血圧低下や循環血液量の低下し、ホルモン系の「レニン-アンジオテンシン-アルドステロン」系が活性化して、Na+が再吸収される。具体的には、以下の通りだ。
腎臓にある「糸球体傍(傍糸球体)細胞」からタンパク質分解酵素の「レニン」が放出され、それにより肝臓などから分泌される「アンジオテンシノゲン」が一部分解されて「アンジオテンシンI」に変化。さらに、アンジオテンシンIは肺などにある「アンジオテンシン変換酵素」によりアンジオテンシンIIに変換される。そして、アンジオテンシンIIが副腎に作用してステロイドホルモンの「アルドステロン」の分泌を促し、同物質は腎臓の「集合管」において、電解質や体液調節に関わるイオンチャネルの「上皮性Na+チャネル(Epithelial Na+ Channel:ENaC)」を介して、Na+の再吸収を促進するというわけだ。
ちなみにイオンチャネルとは、細胞内もしくは外からイオンを選択的に通過させるタンパク質のことだ。またENaCは腎臓尿細管や肺上皮などの上皮細胞膜に局在し、電解質や体液調節に関わる。最近になって、感覚器である味細胞にも発現し、アミロライド感受性の塩味受容体であることが実証された。
さらにNa+が減少すると、生物は「塩味」を手がかりとして外部からそれを摂取して、体内Na+バランスを維持する。この食塩飢餓状態の時には、通常嫌う高濃度の食塩水、Na+を特異的に好んで飲むようになる。つまり、塩味感覚はNa+の恒常性に関わっているというわけだ。なおこの背景として、塩味(Na+)感受性の特異的な低下が起こることが報告されているが、この原因については明らかにはなっていない。
塩味受容機構は少なくとも2つの成分、つまり「利尿剤アミロライド」(ENaCの阻害剤)により抑制される「アミロライド・センシティブ(AS)」成分と抑制されない「アミロライド・インセンシティブ(AI)」成分に分けられる。AS成分はNa+に特異的に応答する成分であり、AI成分はNa+以外にも「K+」や「NH4+」といった電解質にも広く応答する成分だ。
これらの塩味受容体については長い間にわたって不明だったが、AS成分に関しては、近年になってENaCのαサブユニットがその実体であることが明らかにされた。なおENaCには、α、β、γ、δなどのサブユニットが存在することが知られており、これらは3-4量体で機能すると考えられている。
アンジオテンシンIIは、「type1受容体(AT1)」を介して、副腎のみならず血管、脳下垂体、交感神経系などのさまざまな臓器に直接作用し、また脳室内や血中に投与すると、塩分、特にNa+嗜好性を高めることや、その効果は投与後1時間以内に見られることが報告されていた。しかし、塩味感受性に影響するかどうかについては不明だったのである。
塩味感受性の変化については、これまでにアルドステロン投与により塩味感受性が上昇することが報告されていた。これはアルドステロンの味細胞膜通過、核内受容体結合に続く、ENaC合成および細胞質から膜への移行亢進によるものと考えられているが、この効果の発現には投与後数時間が必要なため、アンジオテンシンIIによる素早い食塩嗜好性の上昇は説明できない上に、食塩飢餓のNa+感受性の低下も説明することができないという。
そこで研究チームが立てた仮説が、「アンジオテンシンIIの受容体AT1が味細胞に発現しており、アンジオテンシンIIはAT1を介して味細胞に直接作用し、短時間でENaCを介する塩味感受性を抑制することでNa+摂取量を増やし、引き続き誘導されるアルドステロンは、Na+の体内への吸収を促進すると共に、塩味感受性を上昇することで摂取をストップさせる」というものだ。
アンジオテンシンIIが味覚応答に影響するかどうかを検索するため、今回の研究ではマウスにアンジオテンシンIIを投与し、味覚神経応答および行動応答への影響を調べ、またアンジオテンシンII受容体のAT1と味覚受容体との共発現性の解析がなされた。その結果、アンジオテンシンII腹腔内投与により、C57BLマウスの「鼓索(こさく)神経NaCl応答(AS成分)」が有意に減少することが明らかとなったのである。なお鼓索神経とは、味覚に関わる神経のことだ。
その効果は投与5分後に見られ、30分後にピークを示し、その後コントロール(通常)レベルに戻っていくことが確認された。また、投与後90~120分ではAS成分の応答の増強が見られ、その効果はアンジオテンシンIIにより誘導されたアルドステロンの効果である可能性が推定されたのである。さらに、甘味応答が上昇することも判明。ちなみに、そのほかの味質である酸味、苦味やうま味応答には影響は見られていない。そしてこれらの効果は、AT1特異的阻害剤である「CV11974前処理」により消失した。
マウスの行動応答の解析ではAT1阻害剤投与により、食塩および甘味溶液の飲水量が有意に減少することも明らかとなり、アンジオテンシンIIは神経応答のみならず摂取行動にも影響すること、その効果はAT1を介していることが明らかとなったというわけだ。
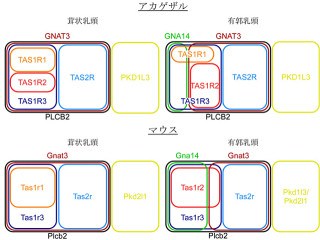
味細胞における発現解析では、AT1はENaCαもしくは甘味受容体構成分子「T1r3(Taste receptor type1member3:味覚受容体I型-3)」と、一部共発現することが確認された。これまでの多くの研究から、塩味受容と甘味受容は別々の細胞群で起こっていることが明らかとなっていたので、アンジオテンシンIIによるAS塩味感受性の抑制効果と、甘味感受性の増強効果はそれぞれ独立した経路で起こっている可能性が予想されるという。
そして、これまでに甘味感受性は「内因性カンナビノイド」によりその受容体「CB1」を介して増強されることが明らかとなっており、またCB1はAT1と複合体を作ることや、AT1を介して活性化されることが報告されていたので、アンジオテンシンIIによる甘味増強効果にCB1が関与している可能性が推定されたのである。
そこで、CB1欠損マウスを用いた解析が行われた結果、アンジオテンシンII投与により、AS塩味感受性の抑制効果は野生型マウスと同様に見られたが、甘味増強効果は見られなかったことから、アンジオテンシンIIによる甘味増強はCB1を介していること、塩味抑制と甘味増強は独立した経路で生じていることが明らかとなったというわけだ。
以上の結果からアンジオテンシンIIは中枢や腎臓のみならず味細胞にも作用して、素早く塩味感受性を抑制すること、その後にはアルドステロンが塩味感受性を上げるという経時的なNa+摂取調節メカニズムが存在する可能性が示唆され、さらに甘味感受性を上げることで糖摂取量を高める可能性が示唆された。
近年の高血圧発症や、そのリスクファクターとしてのNa+の過剰摂取は、その根本に塩味物質などへの過度の嗜好が関与するものと推定されている。従って、食の健全化を通じて健康を維持するためには、食嗜好を決定する味の受容情報伝達システムの分子基盤を解明し、その理解に基づく新たな手段の確立が急務だと、研究チームは語る。
今回の研究結果から広がる「味覚を介したNa+/糖ホメオスタシス維持機構」の分子基盤の解明は、「Na+過剰摂取」や「糖過剰摂取」の原因解明に、そして新規塩味抑制・増強物質の探索は食を介した「生活習慣病に対する新たな予防・治療法の開発」につながることが期待されるという。また味覚器における今回の研究結果は、塩味受容体ENaCが機能する腎臓、唾液腺など全身のNa+代謝組織に反映され、さらに甘味受容体T1rが機能する膵臓、消化管、視床下部など糖代謝組織にも反映される可能性があるとした。
研究チームは今後、AS塩味感受性の抑制効果の分子メカニズムはどうなのか、アンジオテンシンII-アルドステロン関連分子であるレニン、アンジオテンシノゲンやアンジオテンシン変換酵素の関与はどうなのか、そしてヒトでこのアンジオテンシンIIによる味覚感受性調節システムが存在しているのか、存在しているならレニン-アンジオテンシンII-アルドステロン関連分子の遺伝子多型性(SNP)と味覚感受性が相関しているのか、高血圧/肥満/糖尿病発症と塩味/甘味感受性が相関しているのか、など多くの疑問を1つずつ解明していく予定だという。その過程で前述のように健康維持につながる新たなターゲットが生まれるものとしている。