科学技術振興機構(JST)と浜松医科大学、東北大学の3者は4月16日、高真空下でも生命を保護できる「生体適合性プラズマ重合膜」を発明し、生きたままの状態で生物の高解像度な電子顕微鏡観察に成功したと共同で発表した。
成果は、浜松医科大の針山孝彦教授、東北大 原子分子材料科 学高等研究機構の下村政嗣教授らの研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、その詳細な内容は4月15日の週に米国科学雑誌「米科学アカデミー紀要(PNAS)」に掲載される予定だ。
生物は多様な環境で生存するために、さまざまな機能や仕組みを数十億年という長い時間をかけて試行錯誤して発達させてきた。そうした生物が持つ各種機能や表面構造などを解析して模倣し、新しい材料やシステムを開発することを「生物模倣技術(バイオミメティックス)」といい、現在、ホットな分野となっている。中でも同技術の1つとして現在、盛んに研究されているのが、生物の微細構造を模倣した材料開発だ。例えば、ハスの葉の超撥水性、蝶の羽の構造色、さめ肌の低摩擦性などである。
そうした生物表面の微細構造を研究するためには、何よりもまず、その生物表面の微細構造を観察することが重要だ。微細構造を観察するために現在、主に用いられているのが電子顕微鏡である。しかし、高解像度な電子顕微鏡観察で生物資料を観察するには、大きな問題点があった。電子線の透過しやすい高真空環境が必須なため、生物試料を電子顕微鏡内の高真空チャンバーに配置する必要があるのだ。生物は体重(体積)の70~80%ほどを水が占めており、当然ながら高真空下に配置すれば水分が蒸発して体積が収縮してしまい、その表面微細構造は大きく変形してしまうのである。
まして、生きたまま観察するとなると、宇宙に放り出されるようなものなので、ほとんどの生物にとってあっという間に死が訪れてしまうのはいうまでもない。そこで現状では、できるだけ生きてい状態に近い形で観察するために、生物試料を化学固定し、乾燥処理や表面ハードコーティング処理を行うという手法が採られている。また、水の蒸発を抑制するために低真空下での観察を可能とする装置や、生物試料周辺のみの真空度を落とすことを可能とする装置なども開発されている。しかし、どうしても電子線の透過度が低くなってしまい、結果としてこれらの技術では表面微細構造の細部まで観察することは困難という問題を抱えることとなっている。
そこで研究チームは今回、まず浜松医科大の「電界放射型走査型電子顕微鏡(FE-SEM)」を用いて、さまざまな生物を生きたまま高真空下で観察してみた。なお走査型電子顕微鏡は、電子線を絞って電子ビームとして対象試料に照射し、試料から放出される2次電子などを検出することで観察する方式の電子顕微鏡だ。中でも、最近普及が進んでいる電界放射型走査型電子顕微鏡は解像度が高く高倍率での観察が可能という特徴を持つが、10万分の1から1000万分の1Paの高真空環境下(国際宇宙ステーションがある軌道の辺りと変わらない気圧)に試料を保つ必要があり、生物をそのまま観察するのは厳しいという短所がある。
結果は当然ながら、ほとんどの生物は高真空環境におかれて死に至り、その表面構造は体積収縮により変形してしまった。しかし、中にはこの宇宙空間と同等の極限環境に耐え抜いた生物もいたのである。それはショウジョウバエやハチなどの幼虫で、細胞内から分泌された粘性を持つ「細胞外物質(ECS)」を個体の最外層に持つ一部の生物たちであったという。
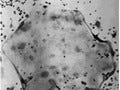
これらの生物は、体積収縮のない微細構造表面を観察することができるだけでなく、電子顕微鏡の中でも活発に動くというタフネスぶりを発揮したのである(画像1)。しかも、1時間経っても生きているものもいて、その生物を電子顕微鏡から取り出して飼育を続けてみたところ、成虫にまで育ったという(昆虫はヒトなどのほ乳類とは異なり、酸素を貯め込める構造をしており、種にもよるようだが、少なくとも今回実験で使われた昆虫たちは、無呼吸状態で1時間はさすがにきついが、30分は普通に生存できるそうである)。
ところが、同じFE-SEM内において電子線照射なしで1時間放置した後に、電子顕微鏡観察するとショウジョウバエの幼虫は体積収縮により変形し、死亡していたのである(画像2)。電子線を照射していた時はあれだけ活発に動いていたいのに逆に照射しないと死んでしまうということから、電子線の照射こそが高真空下でも生命を維持できるカギであると研究チームは結論に至った次第だ。ちなみに電子線は本来、生物にとって決して優しいものではなく、多量に浴びていいものではない。
|
|
|
|
画像1。ショウジョウバエの幼虫(ウジ)を電子顕微鏡内に直接入れて観察すると(A)、0分後(B)から1時間過ぎてもその形態は変化していなかった(C)。「ナノスーツ」は後述 |
画像2。電子線による観察なしで(E)、画像1の(A)と同じ電子顕微鏡内に高真空にだけさらすと、実体顕微鏡下で健常な幼虫(F)が、1時間後には脱水されペシャンコになっていた(G) |
そこで次に、生命が維持されているウジの表面の構造的な特徴を観察するため、FE-SEMによる観察の前後における幼虫の最外層の超薄切断面を作製し、「透過型電子顕微鏡(TEM)」による観察が行われた。TEMもその名の通り電子顕微鏡の1種で、対象試料に電子を当て、それを透過してきた電子が作り出す像を観察する方式のものだ。そのため、生物試料では化学固定したものをプラスチック系の溶剤に包埋・固化した後、できるだけ薄く切り出して観察されることが多い。
観察の結果、電子線照射による観察後の幼虫では、50~100nmの薄膜が形成されていることが判明(画像3・D)。しかし、電子線照射なしで1時間放置した個体の超薄切断面のTEM観察では、最外層の薄膜は観察されなかった(画像3・H)。
これらの事実から、FE-SEM観察時の電子線照射により、幼虫の最外層に50~100nmの薄膜が形成され、それが高真空下での気体や液体の放出を抑制していることがわかったというわけだ。また、FE-SEM観察前にプラズマ照射して同様の実験操作を行うと、電子線照射の場合と同じ結果が得られたという。
以上の結果から、幼虫の最外層にある粘性の高いECSは、電子線またはプラズマ照射により体内の物質の放出を抑制できる50~100nmの薄膜を形成し、高真空下でのFE-SEM観察を実現できることがわかった。この膜は生体適合性のプラズマ重合膜だ。なお、プラズマ重合とは、空気やアルゴンなどの気体に電圧をかけてプラズマを発生させ、そのプラズマと有機物質との反応により生じた「ラジカル(遊離基)」を起点として「モノマー(単量体)」を重合させる方法である。そして研究チームは、この膜を「ナノスーツ」と命名した。
次に、幼虫のECSの成分分析を行い、類似した化学官能基を持つ溶剤を選定し、ECSを持たない生物に対して同等の機能が発現されるのかどうかが試みられた。成分分析の結果や生体適合性という観点から、選択されたのは食品添加物にも指定されている界面活性剤「Tween20」だ。
続いては、直接FE-SEM観察すると体積収縮による変形が起こり、数分の間に平べったくなってしまう蚊の幼虫(ボウフラ)を用いて実験が行われた(画像4・A)。ボウフラにTween20をごく薄く塗布し、プラズマ処理してナノスーツを装着させた後にFE-SEM観察すると、高真空下でも体積収縮がなく微細構造を観察することに成功したのである(画像4・B、C)。
|
|
|
|
ナノスーツ処理したボウフラの電子顕微鏡画像。画像5(左)は、ボウフラが形態変化を起こすことなく動く様子。画像6(右)は、画像5の30分後で、Bの胴体部分や、Cの尾部のブレは活発な動きによるもの。各スケールバーは、300μm |
|
そして画像7が、Tween20塗布およびプラズマ照射なしのボウフラのサンプルだ。画像4で示したように、30分間で堅い骨格を持った頭部以外の胴部はペシャンコになる(A)。(A)の□の部分(一番上の△の左側)を拡大した写真が(B)で、多くのしわが寄っていることが明瞭にわかる。また、(B)の△の部分は電子線によるチャージが生じていることを示している。TEM像では、画像3・Hのウジと同様に最外の層がない(C)。
このようにナノスーツがないとボウフラもすぐに死んでしまうが、ナノスーツを装着したボウフラは微細構造観察時にも活発に活動しており(画像8・D)、観察後に飼育水に戻すと蚊に成長したという。観察後のボウフラの断面をTEMで観察すると、ナノスーツで被覆した試料からはウジの幼虫のECSの場合と同様に、最外層に50~100nmの薄膜が形成されていることがわかった(画像8・E、F)。Tween20でも、ショウジョウバエの幼虫と同様に、電子線またはプラズマ照射により物質の放出を抑制できる薄膜が形成され、FE-SEM観察により生きた状態の微細構造を観察できることがわかった。
|
|
|
|
画像7。Tween20塗布およびプラズマ照射なしのボウフラのサンプル |
画像8。Tween20を人工的に塗布しプラズマ照射することにより高真空内で生命維持できるようにしたボウフラの像(D)。(D)の□の部分を拡大したもの(E)。画像7のBと比べて表面構造の規則性が顕著だ。その表面をTEMで観察(F)。△で示した薄膜がクチクラ表面を覆っていることが示された |
従来の実験方法は、生物試料を化学固定した後、形をできるだけ維持する乾燥法により試料内部の液体成分を除去したのち、試料表面に金やオスミウムなどでコーティングをして観察が行われていた。この方法ではどれだけ注意深く作業を行っても、体内に水分が多い材料では変形を防ぐことは困難で(画像9・A)、高倍率で観察すると未処理の変形(画像7・B)に比べて少ないとはいえ、多くのしわが観察された(画像9・B)。
生きたままのボウフラを観察すると整然と並んだ蛇腹構造が観察された(画像10・C、D)。従来法では、その処理に時間がかかるだけでなく、処理による変形を観察している可能性があった。ナノスーツ法で観察すれば、数分の処理で変形のほとんどない生きたままの姿を観察することが可能となるのである。
|
|
|
|
従来法とナノスーツ法の比較。画像9(左)が従来法(化学固定法)で作製した死んだ試料で、画像10(右)が新規ナノスーツ法で生きたまま観察した試料の電子顕微鏡像。低倍率でも従来法によるサンプル(画像9・A)は痛みが観察されるが、高倍率/高分解能で解析すると、それぞれの表面の微細構造は大きく異なり(画像9・B、画像10・D)、これまでの死んだサンプルでの観察には処理により変形が伴っていたことが判明した |
|
続いて、これまで取り上げた昆虫の幼虫だけでなく、それ以外の動物にもナノスーツ法が適用できるかどうか調べるために、さまざまの生物にナノスーツの装着が試みられた。その結果、電子顕微鏡に入れることのできたサイズのほとんどの動物種で、生命を維持しながら動的な観察を続けることに成功したのである。
画像11はその例の1つで、体表面をナノスーツで保護したハムシの生きたままの電子顕微鏡画像。背中側を試料台に貼り付けて腹側を観察しているが、ハムシは頭や胸部、脚などすべてを自由に動かすことが可能な状態だ。前脚が大きく動いてしまっているので、楕円で囲った部分はブレてしまっている(画像11・A)。動きがたまたま止まった時に前脚第1節の「SETA」と呼ばれる多数の毛状構造が密集していることがわかり(画像11・B)、この構造がどのように接着面と作用しているかを観察することもでき、今後の解析が期待されるという。
今回のナノスーツ法は、従来は不可能だったFE-SEMによる「生きた状態でのさまざまな生物試料の微細構造の観察」ができるようになったことから、革命的ともいえる観察用技術である(画像12)。浜松医科大の針山教授に話を伺ったところ、ナノスーツ法は、電子顕微鏡そのものはあまり改良する必要がなく、生物を動かしたりするためのマニピュレーターを取り付けたり、従来よりも大きな試料を入れられるようにするといった程度で済むとのことだ。ナノスーツを装着させる装置は、顕微鏡とは独立したものなので、改めて電子顕微鏡を購入するといったことも必要ないという。なお、製品化の話はまだなので、開発に協力してもらえる企業が名乗り挙げてくれることを期待しているそうだ。
また、今回は昆虫の観察が行われたが、これ以外にも小動物や細胞などの極微細領域における動きの直接観察が可能になり、生物が持つ未知の現象や行動、組織や細胞間相互作用などの解明が期待されると、針山教授らはコメント。
ナノスーツ法を注意深く用いて、多様な生物の生きた状態での微小領域での高分解能電子顕微鏡観察により、数多くの機能や微細構造を解明できれば、生物学、農学や医学などの生命科学分野での発展のみならず、生物模倣技術をはじめとする「ものづくり」の分野への著しい発展に大きく貢献するものと期待されるともコメントしている。
なお、JSTの今回の発表に関するWebサイトでは、昆虫たちを実際に観察した動画も公開中だ。実際に動いている昆虫たちの全身の縮小画像から、表面の微細構造が見えてくるほどのどこまでも拡大していくような、その革命的な映像もぜひご覧いただきたい。