九州大学(九大)は、東京医科大学、徳島大学の協力を得て、プログラムされた細胞死である「アポトーシス」が生じた細胞が、マクロファージなどの貪食細胞によって取り込まれる際、細胞内にあるタンパク質をリン酸化する酵素「GRK6」が関与していることを見出したと発表した。
同成果は、同大大学院 薬学研究院 薬効安全性学分野の黒瀬等 教授、同・仲矢道雄 准教授、同・薬学研究院 薬理学分野の井上和秀 主幹教授、東京医科大 分子病理学講座の黒田雅彦 主任教授、徳島大 疾患酵素学センター疾患プロテオミクス研究部門の小迫英尊 准教授らによるもの。詳細な内容は、英国時間2月26日付けで英国科学雑誌 「Nature Communications」オンライン版に掲載された。
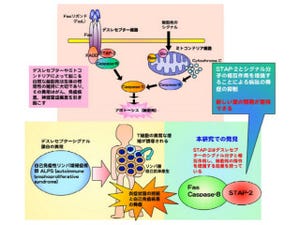
細胞がアポトーシスを起こして死ぬと、その細胞表面に自分自身を貪食するように促す分子群「Eat-meシグナル」が提示され、それを貪食細胞が細胞表面の受容体を介して認識し、死んだ細胞を取り込むために形を変化させていくが、どうして形状変化が引き起こすのかという分子メカニズムには不明な点が多く残されていた。
今回、研究グループは、従来、活性化したGタンパク質共役型受容体をリン酸化し、受容体の活性を低下させるタンパク質として知られていたものの、生体内における役割に関してはほとんどわかっていなかったGRK6に着目して研究を実施。その結果、GRK6が生体内のさまざまなマクロファージに発現しており、貪食時に細胞の形状の変化を促進することで、アポトーシス細胞の貪食を促進する作用を持つことを発見したという。
また、GRK6がこれまで報告されていた形状変化を促進する経路とは異なる、新規の経路を介していることも発見。実際に、マウスの種々の組織におけるGRK6の発現を調べたところ、脾臓に存在するマクロファージにおいて多く発現が認められたとする。具体的には、脾臓は大きく分けて白脾臓と赤脾髄の2つの領域に分けられ、白脾髄はアポトーシスを起こしたB細胞という抗体産生細胞の除去の場、赤脾髄は死んだ赤血球の除去の場として機能しているが、GRK6がそのどちらの領域のマクロファージにも発現していたことから、GRK6欠損マウスを用いて解析を進めた結果、同マウスの白脾髄において、貪食されていないアポトーシスを起こしたB細胞が多く認められたが、赤脾髄では死んだ赤血球の除去がうまくいかないために、中に含まれている鉄がマクロファージに取り込まれずに過剰に蓄積していることが確認されたという。
また同マウスは、アポトーシス細胞の貪食を促進する受容体を欠損したマウスのいくつかの種類と同様、貪食されずに残ったアポトーシス細胞が原因となり、ヒトの自己免疫疾患の1つである全身性エリテマトーデス様の症状を呈することも判明したことから、これら病気の発症にアポトーシス細胞の貪食を通じてGRK6が関与している可能性が示されたと研究グループでは説明している。
そのため、今後は、GRK6を活性化するタンパク質およびGRK6が活性化するタンパク質を探索していくことで、GRK6の機能を制御するための方法を見つけ、それによりアポトーシス細胞の貪食能を調節することを可能とすることで、これらの疾患に対する治療法や治療薬開発へとつなげたいとしている。