理化学研究所(理研)は1月21日、食物や細菌に常にさらされている腸内環境では、免疫応答の司令塔として重要な「ヘルパーT細胞」が、異物を認識して破壊する「キラーT細胞(細胞障害性T細胞:CTL)」と同様の機能を持つ「キラー様T細胞」へと機能変化できることを解明したと発表した。
成果は、理研 免疫・アレルギー科学総合研究センター 免疫転写制御研究グループの谷内一郎グループディレクター、米ラホイヤアレルギー・免疫研究所のHilde Cheroutre教授(理研 免疫・アレルギー科学総合研究センター 環境応答制御研究ユニット ユニットリーダー兼務)らの国際共同研究グループによるもの。研究の詳細な内容は、日本時間1月21日付けで米科学雑誌「Nature Immunology」オンライン版に掲載された。
病原体による感染症から身体を守り、がん細胞を駆逐するなどの重要な働きを担う免疫応答には、それを調節する司令塔の「T細胞」がある。T細胞は、大きく「ヘルパーT細胞」と「キラーT細胞」に分けられ、これらのT細胞は、「CD4」と「CD8」と呼ばれる細胞表面マーカーの発現パターンにより、簡単に見分けることが可能だ。
ヘルパーT細胞は、CD4だけを発現(CD4+CD8-)し、キラーT細胞はCD8だけを発現(CD4-CD8+)する。また、ヘルパーT細胞とキラーT細胞は共通の祖先である前駆細胞を持ち、胸腺で分化・成熟する。この前駆細胞は、CD4とCD8を共に発現していることから「DP胸腺細胞(CD4+CD8+)」と呼ばれる。
つまり、DP胸腺細胞はヘルパーT細胞になるか、キラーT細胞になるか運命選択を行い、ヘルパーT細胞に決定された場合はCD8の発現を消失しCD4+CD8-の顔をしたヘルパーT細胞に、キラーに決定された場合はCD4の発現を消失してCD4-CD8+の顔をしたキラーT細胞に分化するというわけだ。
しかし、DP胸腺細胞がどのようにしてヘルパー/キラーT細胞へそれぞれ分化するのかわかっておらず、その遺伝子発現の制御機構は長い間不明のままだったのである。
異なる機能を持つ細胞(例えばヘルパーT細胞とキラーT細胞)では、ゲノム情報からそれぞれの細胞になるために必要な特定の遺伝子の発現を調節することで、異なる機能を獲得する仕組みだ。
遺伝子発現を調節(転写調節)する核内タンパク質は、「転写因子」と呼ばれる。DP胸腺細胞のような前駆細胞は、転写因子によって特定の遺伝子群の発現を制御するプログラムを作動させ、どの細胞に分化していくかの運命を決定していく。
これまで谷内グループディレクターらは、2002年にキラーT細胞への分化に重要な「Runx転写因子」を同定し、2008年にはヘルパーT細胞への分化に重要な「ThPOK転写因子」の発現を調節する重要な分子メカニズムを解明してきている(画像1)。
これまで、DP胸腺細胞からのヘルパー/キラーT細胞への運命決定は不可逆的であり、いったん決定された運命はその後2度と変更できないと考えられてきた。しかし、最近の研究成果から、ヘルパーT細胞には柔軟な分化能(分化可塑性)があり、あるタイプのヘルパーT細胞から別のタイプのヘルパーT細胞に機能変化できることがわかってきた。
また別の研究から、腸管の上皮細胞の間に入り込んでいる「上皮細胞間リンパ球(Intra Epithelial Lymphocytes:IEL)」と呼ばれる特殊なT細胞群には、CD4とCD8を共に発現しているCD4+CD8+IEL細胞の存在が知られていたが、このCD4+CD8+IEL細胞の機能や分化経路は不明であった。
さらに、Cheroutre教授らは、正常のマウスの脾臓からヘルパーT細胞を分離し、T細胞を持たない別の免疫不全状態のマウス(免疫不全レシピエントマウス)に移入すると、移入したヘルパーT細胞の一部が腸ではCD8を発現してCD4+CD8+という別の顔を示すIEL細胞に変化していることを見出していた。
これらのことは、ヘルパーT細胞に運命決定された細胞がキラーT細胞に変化する可能性を示唆することから、研究グループは今回、Cheroutre教授と共に、胸腺で最初にヘルパーT細胞になるのに必要なThPOK転写因子とCD4+CD8+IEL細胞に着目し、共同研究を開始したというわけだ。
ヘルパーT細胞の分化の引き金となるThPOK転写因子は、ヘルパーT細胞の目印としてCD4以上に重要で、ヘルパーT細胞がその機能を発揮するために必須のタンパク質である。共同研究グループは、まずThPOK転写因子の発現について調べることにした。
そこで作製されたのが、Thpok転写因子の発現の様子を観察するために、緑色蛍光タンパク質(Green Fluorescence Protein:GFP)をThpok遺伝子内に組み込んだトランスジェニックマウス「ThPOK-GFPマウス」である。
ThPOK-GFPマウスの脾臓から分離精製したヘルパーT細胞を免疫不全レシピエントマウスに移入したところ、腸管に移動してCD4+CD8+ヘと変化したIEL細胞ではThPOK-GFPの発現は消失していた。
このことは、キラーT細胞の特徴であるCD8を発現しているだけでなく、ヘルパーT細胞であるために必要なThPOK転写因子の発現を失っていることを示す。つまり、マーカーとしての細胞の顔だけでなく、転写因子の発現消失という遺伝子発現プログラムも変化していることを示唆する。
そこで、CD4+CD8+IEL細胞の詳細な遺伝子発現パターンと試験管内での細胞機能が調べられた。その結果、この細胞はキラーT細胞の特徴となる多くの遺伝子を発現しており、さらにキラーT細胞としての機能を持つことが判明したというわけだ。つまり、腸管に移動したヘルパーT細胞の一部はキラーT細胞と同様の機能を持つCD4+CD8+のキラー様T細胞に変化できることがわかったのである。
次に、ThPOKの発現消失は単なる偶然の一致なのか、キラー様T細胞への変化に重要な出来事なのかを確かめるため、ThPOK転写因子を常に発現するようにしたヘルパーT細胞を作製し、免疫不全レシピエントマウスに移入された。
すると、CD4+CD8+細胞は出現しなくなり、またキラーT細胞に特徴的なほかの遺伝子の発現も見られなかった。この結果から、ヘルパーT細胞からCD4+CD8+のキラー様T細胞ヘの変化にはThPOK転写因子の発現消失が必要であることがわかったのである。
そこで次に、ThPOK転写因子の発現がどのようにして消失するかについて調べられた。なお、これまで理研の研究グループは、胸腺内でキラーT細胞への運命決定が起こる時に、ThPOK転写因子を作り出す遺伝子(Thpok遺伝子)内にある遺伝子の発現を負に制御するサイレンサーが働いて、ThPOK転写因子が発現しないように調節しているメカニズムを発見している。
つまり、このサイレンサーが機能を発揮し、ThPOK転写因子の発現を妨げることで、胸腺内ではDP前駆細胞からヘルパーT細胞への分化経路が遮断されて、キラーT細胞への運命決定が起こるというわけだ。
このことから共同研究グループは、腸管で起こるヘルパーT細胞からキラーT細胞ヘの変化の際にも、胸線内と同じメカニズムが働くかを調べることにした。そのためには、このサイレンサーを持たないヘルパーT細胞を用いた実験を行う必要がある。そこで、共同研究グループは、遺伝子操作によって新しい遺伝子変異マウスを作製した。
このマウスを用いると、いったんヘルパーT細胞を取り出した後に、試験管内でサイレンサー領域除去し、人為的にサイレンサーを除いたヘルパーT細胞を作ることができる。
このヘルパーT細胞を免疫不全レシピエントマウスに移入した実験の結果、CD8+を発現するキラー様T細胞の出現が激減したことから(画像2)、ThPOK転写因子の発現消失にはサイレンサー領域が重要であることがわかったというわけだ。つまり、胸腺でのキラーT細胞への運命決定と同じメカニズムで、腸管でのヘルパーT細胞からキラー様T細胞へ変化していることを突き止めた。
|
|
|
画像2。腸管におけるサイレンサーによるCD4+CD8+細胞への分化の影響。GFP-細胞は、サイレンサーを除かれていない細胞を示す。図中の数値は、CD4+細胞群でのCD8を発現するCD4+CD8+キラー様T細胞の割合(%)を示す |
これらの結果は、T細胞を持たない免疫不全レシピエントマウスに、別のマウスから取り出した細胞を移入するという実験手法で得られたものだ。この実験だけでは、ヘルパーT細胞からキラー様T細胞への変化は免疫細胞がないという特殊な環境下で起こる特殊な出来事なのか、健康な正常マウスでも通常に起こることなのかわからない。
そこで、正常マウスで、いったんヘルパー細胞になった細胞が、その後どのような分化運命をたどるのかが調べられた。実際には、胸腺内のヘルパーT細胞に、細胞分裂などを経て別の細胞など(ヘルパーT細胞の子孫)になっても消えない黄色蛍光タンパク質(YFP)で印をつけることが可能なマウスを作製し、ヘルパーT細胞の子孫の細胞を追跡した形だ(Fate mapping法)。
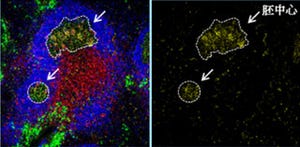
実験の結果、正常マウスの腸に存在するCD4+CD8+キラー様T細胞は、いったんThPOK転写因子を発現してヘルパーT細胞になった細胞の子孫から生じたことがわかったのである(画像3)。
画像3は、Fate mapping法によるヘルパーT細胞のその後の追跡。図のグラフ中の数値は、それぞれの細胞群でのYFPを発現している細胞の割合(%)だ。
上段は胸線。DP胸腺細胞からヘルパーT細胞への分化に従い、YFPの発現が増加する(図中1から5に向かう方向)。キラーT細胞になった細胞ではYFPの発現はほとんど見られない(図中6)。
中段はリンパ節。YFPの発現により、胸線でヘルパーT細胞だった細胞は、リンパ節でもヘルパーT細胞のままであることがわかる(図中7)。キラーT細胞になった細胞にはYFPの発現は見られない(図中8)。
下段は腸管。キラー様T細胞であるCD4+CD8+細胞群(図中10)は、ヘルパーT細胞(図中9)と同様にYFPを発現しているため、ヘルパーT細胞の子孫とわかる。 キラーT細胞にはYFPの発現は見られない(図中11)。
以上の結果は、腸のような特別な環境下ではヘルパーT細胞からCD4+CD8+のキラー様T細胞が発生することを示すものだ。最近の研究では、腸内細菌の種類により腸内のヘルパーT細胞のタイプが異なることもわかってきている。
そこで腸を無菌状態にしたマウスが調べられたのだが、CD4+CD8+のキラー様T細胞は見つからなかった。このことから、CD4+CD8+のキラー様T細胞の分化には腸内細菌から発せられる情報が必要であることがわかったというわけだ。
今回の研究では、CD4+CD8+のキラー様T細胞の分化を強く誘導する単一の腸内細菌は同定できなかったことから、複数の腸内細菌が関与している可能性があるという。
腸内細菌を初め、どのような環境刺激により、CD4+CD8+のキラー様T細胞ヘの変化が誘導されるのか、またCD4+CD8+のキラー様T細胞が実際の免疫応答とその制御においてどのように機能するのか、といった疑問は今後の研究により明らかにすべき課題としている。
今回の研究から、ヘルパーT細胞は、キラー様T細胞へ機能変化するという予想外の秘められた潜在能力を持つことが明らかになったほか、機能変化過程がThPOK転写因子の発現消失によるものだったことから、この過程では細胞の性質をコントロールする根本的なプログラムが書き換えられていることがわかった形だ。つまり、腸管のような環境下のヘルパーT細胞は、細胞機能プログラムを再び書き直す能力を有していることがわかったのである。
このような細胞機能プログラムの書き換えは「リプログラミング」と呼ばれ、人為的にiPS細胞を作製する際に見られる現象と類似のものととらえることが可能だ。
免疫系は、多様な環境の変化に対応する高い適応性が要求される高次生命機能である。これまでは、多様な免疫細胞が血流にのって動き回ることで免疫応答や炎症の局面で入れ替わるという動的な側面が柔軟な対応力の主因と思われていた。
しかし、今回はこれまで注目されていなかったヘルパーT細胞の柔軟な分化可塑性が明らかになった形だ。この成果は、免疫系の環境適応能力の研究に新たな視点をもたらすと考えられるという。
今後、ヘルパーT細胞の柔軟な機能変化の基盤となる機構を解明していくことで、人為的に免疫応答を制御する方法の開発や、ヘルパーT細胞とキラーT細胞の機能を併せ持つ新しいT細胞を作り出すことが可能になるかも知れない。
このような人為的なT細胞分化誘導法の開発は、免疫疾患の新たな治療法の開発につながると期待できると、研究グループはコメントしている。