東北大学と理化学研究所(理研)は、骨髄間葉系幹細胞(骨髄中に存在する幹細胞)からドーパミン神経細胞の誘導に成功し、パーキンソン病モデルのサルの脳内への移植を行ったところ、運動障害などが改善されるとともに、長期にわたり腫瘍形成や副作用が現れないことを明らかにしたと発表した。
同成果は同大大学院医学系研究科の出澤真理 教授と理研 分子イメージング科学研究センターの林拓也 副チームリーダーらのグループによるもので、米国の科学雑誌「Journal of Clinical Investigation」(2013年1月号)の掲載に先立ち、オンライン版に掲載された。
パーキンソン病やアルツハイマー型認知症を含む神経変性疾患では、神経細胞がゆっくりと死に至ることで運動機能や認知機能の低下をきたす。こうした神経細胞死の原因は未だ十分な解明が進んでおらずその予防も困難で、脱落した神経細胞を補充し組織を再生させる根本的な治療法の確立が期待されている。
パーキンソン病は、脳の神経伝達を仲介するドーパミン細胞がなんらかの理由で変性する病気で、体の動きをスムーズに制御できなくなり、運動機能障害が生じる神経難病で、日本でも14万人近くの患者がいると言われている。現在、薬剤投与による症状の緩和が主な治療法となっており、原因である脳内ドーパミン神経の細胞死の予防や、神経細胞を再生させる根本的治療法はまだない。海外では1980年代ごろから中絶胎児の脳の一部を採取し、患者の脳に移植することでドーパミン細胞を新たに供給し、運動機能の改善を図る試験が行われているが、中絶胎児に依存するために安定的な細胞確保が難しいこと、他人の細胞を拒絶する反応を防ぐため免疫抑制剤の服用が必要なほか、倫理性・安全性の問題もはらんでおり、一般的な治療法としては普及していない。
|
|
|
従来のパーキンソン病細胞移植治療。細胞移植は神経変性疾患の夢の治療として1980年代からパーキンソン病を対象とした臨床試験が複数行われてきた。特に中絶胎児脳組織を用いた治療がスウェーデン、米国などで多く試験されてきたが未だ十分な有効性は確立しておらず、2010年にヨーロッパ連合(EU)で新しい臨床試験が開始されている |
こうした問題を踏まえ、治療方法の1つとして患者自身の細胞を用いる自己細胞の移植治療の可能性が検討されている。成体幹細胞の1つである間葉系幹細胞は、骨髄に多く存在し自己増殖能や多分化能をもつ幹細胞として1990年代後半から注目されている。患者自身の骨髄などから採取できるため治療応用のハードルも低く、腫瘍化の危険も低いため移植再生医療の細胞源として候補にあがり、2010年にはパーキンソン病を対象に、成体から採取しただけの分化させていない間葉系幹細胞を移植する臨床試験が海外で始まったが、現状ではわずかな治療効果しか示されておらず、病気の神経組織で必要となる特定の神経機能を再生し、個体の行動機能を回復させるためには不十分で、間葉系幹細胞を高度な機能を有するドーパミン神経に分化誘導させる技術開発が必要とされている。また、間葉系幹細胞以外にも、自己の細胞から誘導した人工多能性幹細胞(iPS細胞)の移植利用も検討が進んでいるが、まだ臨床試験には至っていない。
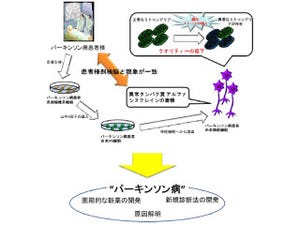
東北大の研究チームは、間葉系幹細胞の機能を解明し、特定の神経細胞を分化させる培養方法の開発を行ってきた。また、理研の研究チームは、PETやMRIなどの分子イメージング技術により、神経変性疾患の病態や移植治療の効果について動物を生きたままで非侵襲的に調べる研究を行ってきており、今回の共同研究では、間葉系幹細胞から特定のドーパミン細胞を誘導し、霊長類パーキンソンモデル動物での自己細胞移植の有効性の検証が行われた。
|
|
|
今回の研究の概略、カニクイザルから骨髄を採取し、骨髄間葉系幹細胞を分離し、Notch(ノッチ)細胞質ドメインや複数の栄養因子で処理したあとドーパミン細胞が誘導された。誘導されたドーパミン細胞をパーキンソン病モデルのカニクイザル脳の線条体に移植することで自己由来の誘導ドーパミン神経移植後の運動機能やドーパミン発現について時間を追って観察、移植の有効性や安全性の検証が行われた |
具体的には、成体カニクイザルの骨髄から採取した骨髄間葉系幹細胞を培養し、ドーパミン細胞に分化させた。ドーパミン神経細胞はいくつかのサブタイプがあるが、パーキンソン病では特にA9型ドーパミン神経とよばれるものが変性・脱落していることが知られている。
今回作製された細胞を免疫細胞化学法により染色したところ、すべてのドーパミン細胞に特異的なタンパク質であるドーパミントランスポーターに加えて、A9型ドーパミン細胞の特徴であるGIRK2(Gたんぱく質共役型内向き整流性カリウムチャンネル)が強く発現していることが確認された。
|
|
|
骨髄間葉系幹細胞から誘導した細胞。免疫細胞化学法により、ドーパミントランスポーター(DAT)、Gたんぱく質共役型内向き整流性カリウムチャンネル(GIRK2)に陽性の染色パターンを示した。この染色パターンは、パーキンソン病で障害されやすいA9型ドーパミン細胞と類似している |
また、同時に他の型のドーパミン細胞(A8やA10)が持つタンパク質(カルビンディン)には陰性であったことから、この細胞がA9型ドーパミン細胞に近い性質を持つことも判明。同様の結果は、逆転写ポリメラーゼ反応という手法により細胞内の遺伝子産物(mRNA)を調べる手法でも確認できたという。
さらに、パーキンソン病モデルカニクイザルを用いて移植実験を行い、移植細胞の有効性と安全性について評価を実施した。具体的には10頭のパーキンソン病モデルのうち、5頭のサルに骨髄間葉系幹細胞から分化したドーパミン神経細胞を移植し、対照として他の5頭には細胞調整液のみを注入し、運動機能の回復と、PETおよびMRIによる移植細胞の評価を行った。
障害側である左前肢で餌をつかむ際の速度やふるえの改善状況を観察したところ、運動機能は移植4~8カ月後に回復したという。脳内で機能しているドーパミン神経は神経伝達物質であるドーパミンを放出するが、放出するとすぐに細胞内に取り込んで再び次なる活動に備える機能を有している。この機能は細胞表面にあるドーパミントランスポーターによってもたらされることから、脳内の移植細胞の機能をドーパミントランスポーターに対するPETプローブ(11C-CFT)を用いたPETで観察したところ、ドーパミントランスポーターの発現が移植直後に顕著に上昇し、その後徐々に減少はするものの、7カ月後においても移植前より高い値を安定的に維持していることが判明した。これらの結果は、移植9カ月後に行った脳組織の顕微鏡観察からも確認されたという。
加えて、MRIや18F-FDGを用いたPET検査や免疫組織化学法から、移植片が腫瘍化せず、全身状態や血液検査でも副作用が無いことも示されたという。
研究グループでは、これらの結果から、骨髄間葉系幹細胞から誘導したドーパミン細胞が移植後長期間にわたって生着・機能し続けることで、パーキンソン病の運動機能障害が徐々に回復に向かったものとの結論に達したとする。
骨髄の間葉系幹細胞は安定的に増える細胞であるため、比較的少量の骨髄液を取れば細胞治療に必要とされる細胞数確保が可能だ。また、分化した細胞が腫瘍化しなかったという結果は臨床応用において重要な点だと思われ、自己の細胞を用いて失われた組織の細胞を再生し、移植することで組織本来の機能回復が可能であることを霊長類動物(パーキンソン病モデルカニクイザル)で証明した世界で初めての成果になるという。
なお研究グループでは今後、移植細胞の長期生存能や機能再生をさらに向上させる技術を開発し、パーキンソン病を含めた神経変性疾患の自己細胞による治療法の確立を目指すとしている。