理化学研究所(理研)は11月21日、「脂肪細胞」表面に局在するGタンパク質共役受容体(GPCR)の1種「GPRC5B」が、肥満による2型糖尿病の発症において重要な役割を果たすことを発見したと発表した。
成果は、理研 脳科学総合研究センター 神経膜機能研究グループのYeon-Jeong Kim研究員、平林義雄チームリーダーらによるもの。詳細は、日本時間11月21日付けで米科学雑誌「Science Signaling」オンライン版に掲載され、印刷版にも掲載の予定だ。
生体エネルギーの元となる脂肪は、食物から摂取したり体内で炭水化物から合成したりして主に脂肪組織に蓄積されている仕組みだ。蓄積された脂肪は、さまざまな分解経路を経てエネルギーに変換され、生物はそれを利用して生命を維持している。
脂肪の蓄積と消費のバランスを制御することは、ヒトも含め生命体の健全性を維持する上で重要だ。食物の過剰な摂取や枯渇による蓄積-消費バランスの破綻は、さまざまな病気の発症につながってしまう。
特に近年になって、糖尿病、高脂血症、高血圧症などの疾病リスクを高める肥満は増加の一途をたどっており、早急な予防対策が求められている。肥満の分子メカニズムを理解するためには、組織間で制御されているエネルギー代謝を調節する仕組みを調べることが重要だ。しかし、この仕組みは複雑で容易に明らかにすることは困難である。
最近の研究により、細胞膜上の構造がエネルギー代謝制御に深く関係していることがわかってきた。2008年に研究グループは、ヒトからショウジョウバエまで共通して保存されているGPCRの1種「BOSS/GPRC5B」を発見し、その機能を詳細に解析。この結果、BOSS/GPRC5B遺伝子は、ショウジョウバエでは複眼形成過程に関わる「Svenless遺伝子」に関連する因子として中枢神経細胞に発現していたが、それだけではなく脂肪体(脂肪組織)にも発現していて、体全体のエネルギーバランスの維持に関わる「膜機能分子」であることが発見されたのである。
研究グループは今回、GPRC5Bが関わる詳細なエネルギー代謝制御機構の理解を目指して、その機能やそれに関わる因子など解明に挑んだ。具体的には、ヒト胎児腎細胞由来の培養細胞を用いて、GPRC5Bと結合する因子を含んだタンパク質複合体を分離精製し、「分子ふるいクロマトグラフィー」で解析した。
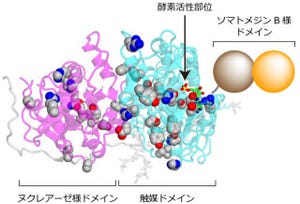
その結果、GPRC5Bは、細胞膜上で細胞内外シグナル発信の基地となる領域の「脂質ラフト」に存在するタンパク質「カベオリン‐1」と一緒に脂質ラフトに局在することがわかったのである。脂質ラフトは、細胞外との情報伝達に使われる受容体や酵素が密集している通路だ。
さらに、情報伝達に重要な役割を担うチロシンリン酸化酵素の1種「Fyn」とも結合することが見出された(画像1)。
また、GPRC5BとFynの結合が、Fynのリン酸化酵素活性に影響するかどうか調べるために、Fynと結合しないGPRC5B変異遺伝子を作製。正常のGPRC5BとFynの酵素活性を比較すると、GPRC5B変異遺伝子ではFynの酵素活性は低下することが確認された(画像2)。これらのことから、GPRC5Bは脂質ラフトでFynの酵素活性制御に必要な因子であることがわかった。
なお、画像1(左)と2(右)は、GPRC5BはFynと結合し、Fynの活性を上昇させるという証拠。画像1は、分子ふるいクロマトグラフィによるGPRC5Bタンパク質複合体の分離・精製だ。GPRC5Bタンパク質複合体は、カベオリン-1(Cav1)とFynで構成されることがわかった。
画像2のグラフでは、Fynと結合する野生型(正常の)GPRC5B(5B-WT)を発現した細胞ではFynの活性上昇が見られるが、Fynと結合しないGPRC5B変異遺伝子(5B-Y383F)を発現する細胞では、Fynの活性上昇が見られない。
一方、「ゲノムワイド関連解析」において、GPRC5Bは肥満と関連していることが報告されていた。GPRC5Bの機能と肥満および2型糖尿病との関連性を探るため、研究グループはGPRC5B遺伝子欠損マウスを作製。野生型マウスとGPRC5B遺伝子欠損マウスに高脂肪食を与えたところ、野生型マウスは劇的に肥って2型糖尿病を発症したのに対し、GPRC5B遺伝子欠損マウスは肥らなかった(画像3)。
次に、これらのマウスにグルコースとインスリンを与え、時間ごとに血中のグルコース量が測定された。正常な野生型マウスだと血中のグルコース濃度は速やかに一定量まで下がり保たれる。
しかし、糖尿病を発症した野生型マウスでは、インスリン感受性が低下する(効かない)ためグルコースの血中濃度はなかなか下がらない。ところが、GPRC5B遺伝子欠損マウスはインスリン感受性が高く、肥満による2型糖尿病の発症が抑制されていることがわかった(画像4)。
画像3(左)と4(右)は、GPRC5B遺伝子欠損マウスは肥らず、高いインスリン感受性を示すという証拠。
画像3は、高脂肪食および一般食を食べさせたマウスの体格と、体重の変動の測定結果。高脂肪食投与により、野生型マウス(+/+)は肥るが、GPRC5B遺伝子欠損マウス(-/-)は肥らない。また、一般食投与の場合は両者に大きな差は見られなかった。
画像4は、高脂肪食を与えたマウスにグルコースおよびインスリンを投与してのグルコース負荷試験(血液中のグルコースの量)とインスリン負荷試験。
グルコース負荷試験では、正常な野生型マウスだとインスリン分泌されて働くことで、細胞中にグルコースが取り込まれ血中グルコース濃度(血糖値)が速やかに一定量まで下がることがわかる。
しかし、高脂肪食を与えた野生型マウス(+/+)は、肥満のためインスリンが働かないため血糖値は下がり難くなり、糖尿病を発症する。今回、GPRC5B遺伝子欠損マウス(-/-)ではいずれも血糖値が下がり、インスリン感受性が高く、肥満による糖尿病発症が抑制されていることがわかった。
肥満は2型糖尿病の主な原因であり、脂肪組織の慢性炎症が一般的な所見として知られていて、肥満と慢性炎症の相関関係は以前より注目されている。近年、脂肪組織の慢性炎症を活性化する新しい因子としては、自然免疫やガンに関係したタンパク質リン酸化酵素「IKKε」が注目されているところだ。
野生型マウスとGPRC5B遺伝子欠損マウスに高脂肪食を与える実験でIKKεの発現量の推移を調べて見ると、野生型マウスの脂肪組織ではIKKε発現量が増加するが、GPRC5B遺伝子欠損マウスの脂肪組織では低い発現量のままだった(画像5)。
また、脂肪組織の慢性炎症の有無を判断する指標因子も同じく上昇しないことが判明(画像6・左)。
過去の研究によりIKKε遺伝子欠損マウスは、体内の基礎代謝量が上昇することによって抗肥満であることが知られていたが、同様にGPRC5B遺伝子欠損マウスでも基礎代謝量が上昇することで肥満を抑制することがわかった(画像6・右)。
画像5~6は、肥満による脂肪組織の慢性炎症と代謝量。画像5は、慢性炎症に中心的な役割を担うIKKεの発現量を比較したもの。高脂肪食により野生型マウス(+/+)の脂肪組織ではIKKε発現量が増加するが、GPRC5B遺伝子欠損マウス(-/-)の脂肪組織では低い発現量を示した。なお、TBK1はコントロールとして用いている。
画像6の左は、野生型マウス(+/+)とGPRC5B遺伝子欠損マウス(-/-)で、脂肪組織での慢性炎症の指標となる遺伝子(MCP1、TNF-α、F4/80、iNOS)の発現を比較したもの。野生型マウスに比べ、GPRC5B遺伝子欠損マウスは低い水準を示した。
画像6の右は、野生型マウス(+/+)とGPRC5B遺伝子欠損マウス(-/-)による、明暗での代謝量の比較したもの。IKKε遺伝子欠損マウスのように、GPRC5B遺伝子欠損マウス(-/-)の代謝量は明暗いずれの場合も野生型マウス(+/+)に比べて高い結果となった。マウスは夜行性のため、夜に活動することから暗の状態のほうが代謝量が高い。
|
|
|
|
画像5。野生型マウス(+/+)とGPRC5B遺伝子欠損マウス(-/-)による、慢性炎症に中心的な役割を担うIKKεの発現量の比較 |
画像6。野生型マウス(+/+)とGPRC5B遺伝子欠損マウス(-/-)による、左が脂肪組織での慢性炎症の指標となる遺伝子の発現の比較で、右が明暗での代謝量の比較 |
さらに研究グループは、GPRC5Bによる情報伝達システムがどのようにして肥満による慢性炎症を制御するのかを探る目的でマウス胎児線維芽細胞由来の培養細胞を用いた解析に着手した。
GPRC5B遺伝子を発現させた細胞はIKKεの発現が上昇することが判明。ところが、Fynと結合しないGPRC5B変異遺伝子を発現させるとIKKεの発現には変動がなかったのである(画像7)。これらのことから、GPRC5BによるFynの酵素活性がIKKεを主軸とする慢性炎症の引き金となる情報伝達システムであることがわかったというわけだ(画像8)。
画像7は、GPRC5BとFynの結合はIKKεの発現を上昇させることを示したもの。GPRC5B遺伝子欠損細胞にGPRC5B遺伝子(5B-WT)を発現させるとIKKεの発現量が増える。しかし、Fynと結合しない変異GPRC5B遺伝子(5B-Y383F)を発現させると、IKKεの発現量は増えない。
画像8は、GPRC5Bによる脂肪組織慢性炎症の制御機構の模式図。GPRC5Bは細胞膜上の脂質ラフトに存在し、Fynの酵素活性を制御することで生物が生きるために大切なエネルギーの蓄積を促す装置であり、Fynの酵素活性がIKKεを主軸とする慢性炎症の引き金となる情報伝達システムであることが示された。
細胞膜上の脂質ラフトに局在するGPRC5Bは、Fynと結合してその酵素活性を制御し、生物が生き残るために大切なエネルギーを上手に蓄積する装置であり、そしてそれらの情報伝達システムが肥満や2型糖尿病の発症に重要な役割を果たしていることが解明された。
肥満による脂肪組織の慢性炎症は2型糖尿病の治療標的となる重要な生命現象であるため、今回の研究の成果が新しい治療戦略の開発に役立つことが期待できると研究グループはコメントしている。