基礎生物学研究所(NIBB)とアスビオファーマは11月8日、タンパク質チロシン脱リン酸化酵素「Ptprz」が、中枢神経系における「髄鞘(ミエリン鞘)」(画像1)の形成・再形成の制御に関わることを明らかにしたと発表した。
また、Ptprzを欠失させたマウスでは発生期の脳内において髄鞘の形成開始が早まっており、また成体においても実験的な脱髄に対して抵抗性があり髄鞘の再形成能が亢進していることが見出された形だ。また、分子・細胞レベルの解析から、髄鞘の形成に関わる細胞内シグナル伝達に対してPtprzが抑制的に働く仕組みも明らかになったと併せて発表している。
成果は、NIBB 統合神経生物学研究部門の野田昌晴教授と、アスビオファーマの研究者らの研究グループによるもの。研究の詳細な内容は、日本時間11月8日付けで米オンライン科学誌「PLoS ONE」に掲載された。
タンパク質の特定の「チロシン残基」に認められる可逆的なリン酸化修飾は、細胞増殖、細胞接着・移動、細胞-細胞間のコミュニケーションといったさまざまな細胞機能に関わる細胞内シグナル伝達の基本的な仕組みだ。
この反応はリン酸基を付加する「プロテインチロシンキナーゼ(PTK)」と、その逆にリン酸基を除去する「プロテインチロシンホスファターゼ(PTP)」によって制御される。
PTKファミリーは、「トランスフォーメーション(形質転換)因子」として発見された経緯もあり、ガン治療薬開発における主要な創薬標的だ。一方、PTPはPTKに約10年遅れて発見され、その役割やシグナル伝達の仕組みは今もよくわかっていない。
NIBB統合神経生物学研究部門では、主に脳・脊髄・網膜など中枢神経系に発現しているPTPファミリー分子であるPtprzについての研究が長く続けられている。最近になって、Ptprzが細胞内で脱リン酸化する基質タンパク質に、共通する「モチーフ構造」があることが発見され、Ptprzによって制御される細胞内シグナル伝達系に対する理解が進んだところだ。
基質タンパク質の1つである「p190RhoGAP」は、細胞の形や運動に関わる細胞骨格系の制御に関わっている。「オリゴデンドロサイト」は、その細胞膜を神経軸索に巻き付けて、髄鞘と呼ばれる絶縁体を形成し、神経伝達速度を高めるなどの役割を担う。
オリゴデンドロサイト系列の細胞において、p190RhoGAPは、PTKの1つである「Fynキナーゼ」によるリン酸化によって活性化し、細胞の分化を促し髄鞘形成を誘導する仕組みである。
これらの先行知見から、アクセルに相当するFynキナーゼに対して、Ptprzがブレーキのように働く役割が推測された。そこで、すでに同研究部門で作出していたPtprz遺伝子の欠失マウス(Ptprz欠損マウス)を用いて動物個体レベルでの実証研究が行われた。
髄鞘の主要な構成タンパク質であるミエリン塩基性タンパク質(MBP)の発現量を、マウス脳内で髄鞘形成が開始される生後10日で調べて見ると、Ptprz欠損マウスではMBPの発現量が野生型マウスに較べて有意に増加していることが判明(画像2~5)。
生後10日齢の脳組織を電子顕微鏡観察すると、Ptprz欠損マウスの神経繊維の髄鞘化が野生型マウスよりも早く進んでいたのである(画像2・3の下側(脳梁部の拡大図))。
|
|
|
|
発生期のPtprz欠損マウスにおけるミエリン塩基性タンパク質の発現量および有髄神経繊維の増加その2。生後10日齢(画像4(左))および3ヶ月齢(画像5)の脳組織の電子顕微鏡観察。スケールバーは2μm。下段グラフは有髄神経繊維の存在比の定量評価。*P<0.05・5 |
|
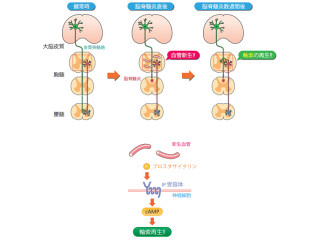
初代培養細胞系を用いた解析でも、Ptprz欠損マウス由来の細胞は、オリゴデンドロサイトへより早く分化することが確かめられた。Ptprzは、神経軸索が髄鞘で覆われる発達期がくるまで、オリゴデンドロサイトを前駆細胞の状態にとどめておくストッパーのような働きを担うと考えられる(画像6)。一方、成体である3カ月齢になると、このような差異は消失していた(画像3)。
画像6は、オリゴデンドロサイトの分化および髄鞘形成に関わるPtprzの役割を示したもの。Ptprzは、Fynキナーゼによってリン酸化されたp190RhoGAPを脱リン酸化して、その働きを抑えることで、オリゴデンドロサイトへの分化/髄鞘の形成を抑制している。
一方、「PTPα」、「CD45」、「SHP-1」といったほかのチロシンホスファターゼ分子はFynキナーゼを活性化し、オリゴデンドロサイトの分化を促進する働きが報告済みだ。なお赤線は活性化、青線は抑制的作用を示している。
Ptprzの発現は発達期に限らず成体組織でも持続している。そこで、一見変化が認められない成体マウスにおいて強制的に脱髄を誘導した時の応答性の解析が行われた。
脱髄は、髄鞘の構成成分に由来するペプチド抗原をマウスに免疫投与して「実験的自己免疫性脳脊髄炎(EAE)」を誘導する手法を使用。EAEは、「多発性硬化症」の動物モデルとして広く研究に用いられるものだ。なお、多発性硬化症は主要な脱髄疾患であり、一般に炎症、脱随、神経変性を伴う中枢神経系の自己免疫疾患と考えられている。
その結果、Ptprz欠損マウスでは、四肢麻痺など、EAEの症状が野生型マウスに較べて軽く(画像7)、それに対応して脊髄組織における髄鞘損傷も軽減されていた(画像8)。
EAE傷害部位への炎症性細胞の浸潤の程度は野生型マウスと差異がないことから、EAEの症状の軽減は、免疫応答の差異に起因するものではないと考えられた。この結果は、成体のEAE傷害時においても、Ptprzはオリゴデンデンドロサイトの分化や髄鞘の形成/再形成に対して抑制的に働いていることを示している。
画像7は、EAEに対するPtprz欠損マウスの抵抗性(臨床的評価)。ミエリンオリゴデンドロサイト糖タンパク質(MOG)由来のペプチド抗原による免疫感作(0日)後の症状の経過観察をしたもの。P<0.05、*P<0.01。
画像8は、EAEに対するPtprz欠損マウスの抵抗性(組織学的評価)。抗MBP抗体を用いたMOGペプチド抗原による免疫感作35日後(EAE誘導群)と無処置対照群の脊髄組織のMBPの免疫染色解析したもの。スケールバー500μm。下図は上図の四角エリアの拡大。下段グラフはMBP染色強度の定量評価。Ptprz欠損マウスではMBPがほとんど失われていない。**P<0.01。
|
|
|
|
画像7。EAEに対するPtprz欠損マウスの抵抗性(臨床的評価)。ミエリンオリゴデンドロサイト糖タンパク質(MOG)由来のペプチド抗原による免疫感作(0日)後の症状の経過観察。*P<0.05、**P<0.01 |
画像8。EAEに対するPtprz欠損マウスの抵抗性(組織学的評価) |
現在、「脱髄疾患」の新たな治療薬として、脱髄部位に存在するオリゴデンドロサイト前駆細胞を積極的にオリゴデンドロサイトに分化・成熟させて、髄鞘の再形成を促すような薬剤の開発が求められている。今回の研究で明らかになったオリゴデンドロサイト分化の分子メカニズム(画像6)は、Ptprzの酵素活性を選択的に阻害する化合物の有効性を示唆している。
今回の成果により、発達期の脳神経系においてPtprzが関わる髄鞘が形成される仕組みが明らかになった形だ。研究グループは、有効な治療手段の確立されていない脱髄疾患に対する新薬開発においてPtprzは、有望な標的分子の1つになると考えられるとしている。