東京大学は、胎生期における「神経幹細胞」のニューロン分化に中心的な役割を果たす遺伝子「Neurog1」の発現調節に、「非コードRNA(ncRNA)」が決定的な働きをしていることを示したと発表した。
成果は、東大 分子細胞生物学研究所の後藤由季子教授、同・小野口真広学術支援職員らの研究グループによるもの。研究の詳細な内容は、10月1日付けで米国科学雑誌「米科学アカデミー紀要(PNAS)」に掲載された。
ほ乳類の大脳は、さまざまなタイプのニューロンが脳の決められた領域に配置され、互いにネットワークを形成することにより高度な機能を発揮する。これらのニューロンは、胎生期に神経幹細胞が適切に分化することで産生されていく。
「Neurog1」は神経幹細胞がニューロンに分化する際の決定因子の1つとして知られており、Neurog1の発現がONになることが、ニューロン分化に重要だ。したがって、Neurog1の発現がどのように制御されているのかを解明することが、神経幹細胞がニューロンを生み出し、脳を構築していく過程を理解する上で重要であると考えられる。
遺伝子の発現制御には、DNA配列上に存在する「エンハンサー」と呼ばれる制御領域が重要な役割を果たす。一般的にエンハンサーは、転写因子などの遺伝子の発現を調節するタンパク質が結合する足場となる領域であると考えられている。
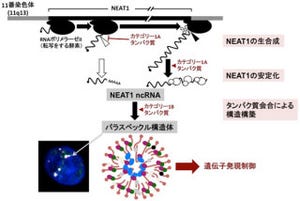
今回の研究では、エンハンサー領域のDNAの塩基配列の特徴に注目し、この領域から新規の非コードRNA(ncRNA)が転写されていることを発見した形だ。この非コードRNAは「utNgn1」と名付けられた。
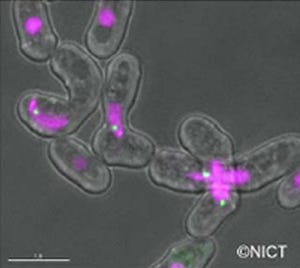
utNgn1の発現を胎生期のマウスの脳で詳しく調べると、utNgn1はNeurog1の発現パターンと高い相関を示すことがわかり、神経幹細胞がニューロンに分化する際に発現が上昇することが判明。
重要なことに、utNgn1の働きを阻害すると、Neurog1の発現が減少することがわかった。これらの結果から、utNgn1はNeurog1の発現を正に制御する新たな制御因子であると考えられたのである。
ほ乳類のゲノムの大部分は遺伝子がコードされていない領域で占められており、これらの大半の領域は意味を持たない"ジャンクDNA"であると考えられてきた。
最近の研究の進展により、これらの領域を含むゲノムのかなりの部分から、遺伝子のタンパク質をコードしていない非コードRNAが転写されていることがわかってきた。
しかし、これらの多くは、遺伝子が転写される際の副産物、すなわち"ノイズ"のようなものではないかと考えられており、非コードRNAにどのような役割があるのかについては、わずかな一部の例を除いて、ほとんど明らかにされていない。
今回の発見は、これまで大きな謎であった非コードRNAの役割の一端を示すものであり、遺伝子の発現制御の仕組みに新しい機構が存在する可能性を示唆しているという。
最近、ほかの複数の研究グループからも今回の成果と同様の遺伝子発現制御機構が、ほかの細胞や遺伝子においても存在する可能性があることを示唆する報告がなされている。
これらの報告と共に、今回の研究はこれまでの遺伝子発現制御機構に対する考え方を大きく変えていくものであると考えられると、研究グループはコメント。
また、このような非コードRNAが担う未知の機能やその作用機序が解明されれば、将来的に、遺伝子の発現制御機構の破綻により引き起こされるさまざまな疾患の原因の解明や、新たな治療方法へのアプローチにつながる可能性を持っているとも語っている。