理化学研究所(理研)は9月18日、ウイルスや細菌などの異物に対する「自然免疫」や初期の感染防御に必須な、「免疫グロブリンM(IgM抗体)」の受容体「FcμR(エフシーミューレセプター)」の機能を明らかにしたと発表した。
成果は、理研 免疫・アレルギー科学総合研究センター 免疫多様性研究チームの王継揚チームリーダーと、同・免疫系構築研究チームの大野博司チームリーダーらの研究グループによるもの。研究の詳細な内容は、日本時間9月18日付けで「」米国科学雑誌「米国科学アカデミー紀要(PNAS)」オンライン版に掲載され、印刷版にも掲載される予定だ。
我々の体は、体内に侵入したウイルスや細菌などの病原体を排除する免疫システムを持っている。中でも、免疫細胞の1種の「B細胞」が分泌する抗体は、外からの異物をいち早くキャッチし除去するために必須だ。
分泌する抗体にはIgM、「IgD」、「IgG」、「IgA」、「IgE」の5種類があり、それぞれ異なった機能を持つ。中でもIgM抗体は、病原体が侵入した際に最初に産生され、感染の初期防御に重要な役割を果たす。
抗体は病原体やそれが産生する毒素に直接結合し、それらを不活性化したり中和したりすることが可能だ。ただし、抗体は病原体に結合しただけでは十分な免疫力を発揮できない。さまざまな免疫細胞表面上の受容体と結合して、侵入した病原体を免疫細胞内へ取り込んで分解を促進し、病原体の増殖を妨げて感染を防いでいる。
一方で、抗体の受容体は、免疫細胞の活性化を制御する機能も持つ。例えば、B細胞上のIgG抗体の受容体「FcγR2b」は、B細胞の過剰活性化を抑え、病原体に対する行き過ぎた免疫応答を抑制することが知られている。
これまでの研究で、IgG、IgA、IgE抗体の受容体が生体内で果たす機能はわかっていた。また、IgAとIgM抗体の両方に結合できる受容体の存在も明らかになっている。
2009年に研究グループは、長年不明だったIgM抗体に特異的に結合する受容体「FcμR」の遺伝子を発見したほか、受容体FcμRはB細胞だけで発現し、免疫制御の中心的役割を果たすT細胞やそのほかの免疫細胞には発現しないことも明らかにしている。しかし、生体内での詳細な機能については謎のままだった。
そこで今回、遺伝子改変技術によりFcμR遺伝子を欠損させて、受容体FcμRを産生しない「FcμR欠損マウス」を作製し、正常な(野生型)マウスと免疫応答について比較を実施した。その結果、FcμR欠損マウスのB細胞の分化と成熟に大きな異常はないものの、成熟したB細胞は抗原刺激後に死にやすいことが判明した。
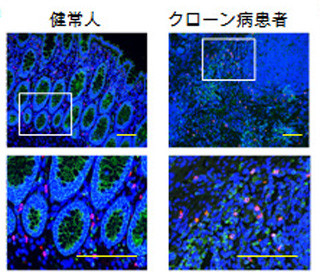
また抗原が侵入すると、野生型マウスではB細胞が活性化されて激しく細胞分裂を繰り返し、「胚中心」と呼ばれる組織構造を形成。しかし、FcμR欠損マウスでは胚中心の形成が野生型マウスの約4分の1に低下し、生体内でのB細胞の活性化と増殖が顕著に阻害されることがわかったのである(画像1・2)。
この結果、胚中心よりB細胞から分化した抗体産生細胞と「記憶B細胞」の数も減少して、抗体産生が2分の1から3分の1に低下し(画像3・4)、FcμR欠損マウスが免疫不全の状態にあることが判明。以上から、受容体FcμRは病原体に対する抗体産生の誘導に重要とわかった。
なお記憶B細胞とは、病原体侵入後に活性化されるB細胞のことで、体内に長期生存でき、同じ病原体が再度侵入した際に素早く活性化されて抗体を産生して増殖を防ぐことができるという機能を持つ。
|
|
|
|
野生型(画像1(左))とFcμR欠損マウス(画像2)における胚中心形成。抗原が侵入すると、野生型マウスでは大きな胚中心(緑)を形成するのに対し、FcμR欠損マウスでは、その大きさは野生型マウスの約4分の1に低下していた。スケールバーは0.1mm。(赤:T細胞、青:胚中心以外のB細胞、およびそのほかの細胞(樹状細胞など)の核、緑:胚中心B細胞) |
|
研究グループが「興味深いこと」として、FcμR欠損マウスは、正常な抗体産生機能が低下しているにも関わらず加齢と共に、リウマチの原因となる自己の抗体に対する抗体や、「膠原病」などの自己免疫疾患で増加する自己のDNAや核タンパク質に対する抗体を産生することが判明(画像3)。
また、自己免疫疾患で「糸球体腎炎」がしばしば観察されるが、その指標となる尿タンパク質も増加傾向にあった。これらにより、FcμR欠損マウスは年を取ると、重い自己免疫疾患を発症する可能性が高いことがわかり、受容体FcμRは自己の抗原に対する抗体産生を抑制していることが明らかとなったのである。
画像3のA:血中の全IgG抗体量、B:IgG抗DNA抗体、C:リウマチ因子、D:IgG抗細胞核抗体。○:野生型マウス、●:FcμR欠損マウス。野生型マウスに比べ、血中の全IgG抗体量(A)は変わらないが、自己抗体である血中の抗DNA抗体(B)、リウマチ因子(C)および抗核抗体(D、緑)はFcμR欠損マウスで顕著に増加していることが確認された。
今回、IgM抗体の受容体FcμRは、抗原に対する抗体産生に極めて重要であることがわかった。すでに、IgG抗体の受容体であるFcγR2bは、抗原に対する過剰な免疫応答の抑制に必須であることが示されている。従って、FcμRとFcγR2bは免疫応答をそれぞれ「正」と「負」に制御することが明らかになった。
免疫システムでは、病原体が体内に侵入すると病原体に対する特異性が低いIgM抗体が最初に産生され、病原体の感染や増殖を第一線で防御する。その後、病原体に対し特異性が高いIgG抗体を産生し、病原体を完全に撃退する。
今回の知見から、免疫応答の初期には、IgM抗体が生体防御に働くと同時に受容体FcμRが免疫応答をさらに促進させ、免疫応答の後期に、IgG抗体が病原体を完全に駆逐すると同時に受容体FcγR2bは、過剰に免疫応答が起きないようにB細胞の活性化を抑制する、という巧みな免疫システムが働いていると予想された。
受容体FcμRは、外来抗原に対しては免疫反応を促進する、いわばアクセルのような働きをする一方、自己の抗原に対しては、抗体産生を抑制する、いわばブレーキのような役割を果たすことが明らかになった形だ。
外来抗原かあるいは自己抗原かによって、アクセルとブレーキを踏みわける、巧みな制御メカニズムについては、今後のさらなる解明が待たれる。なお、FcμRはB細胞の「免疫寛容」の成立にも関わっている可能性があるという。
今後、受容体FcμRのさらなる機能解明により、今まで原因不明だった免疫不全、自己免疫疾患およびアレルギー疾患の解明につながり、受容体FcμRの活性を人為的に制御すると、免疫疾患の治療への応用が可能になると期待できると研究グループは語る。
さらに、受容体FcμRは慢性リンパ性白血病細胞で異常に高く発現しており、そのメカニズムを解析することで、白血病発症機構の解明や治療にも寄与すると考えられるとも述べている。