理化学研究所(理研)と岡山大学は9月11日、かずさDNA研究所の協力を得て、病原体に感染した時だけ植物の免疫力を高め、耐病性を向上させる化合物(薬剤)「プラントアクティベーター」を新たに5個発見し、その作用メカニズムを解明したと共同で発表した。
成果は、理研植物科学研究センター 植物免疫研究グループの白須賢グループディレクター、同・生長制御研究グループの神谷勇治グループディレクター、同・軸丸裕介研究員、同・花田篤志技術員、岡山大学異分野融合先端研究コアの能年義輝助教(特任)、同・岡﨑正晃研究員、同・仁科勇太助教(特任)、同・喜田拓也研究員、かずさDNA研究所 産業基盤開発研究部 産業応用技術研究室の柴田大輔室長、同・鈴木秀幸主任研究員、同・森下宜彦技術員、同・小川拓水研究員らの共同研究グループによるもの。研究の詳細な内容は、近日中に米国科学誌「The Plant Cell」オンライン版に掲載される予定だ。
プラントアクティベーターと呼ばれる一群の化合物は、植物そのものの持つ免疫力を高め、その耐病性を向上させる薬剤だ。複数の病害に対する広範な防除効果と、薬剤耐性菌による効果の減衰もない点が特徴である。そうした理由から、特に東アジアの水稲栽培において広く利用されている。
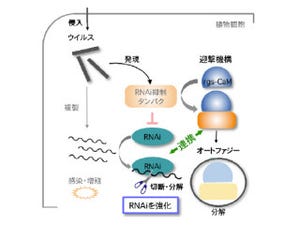
また、プラントアクティベーターの利用によって殺菌性農薬の使用回数や量を低減できることから、持続的で環境負荷の少ない農業の実現に向けた利用拡大が期待されているところだ(画像1)。
プラントアクティベーターは、これまでは偶然発見された薬剤をもとに、主にイネ栽培に特化した開発が進められてきた。しかし、さまざまな作物種に適用可能なプラントアクティベーターを開発するには、既存の薬剤とは異なる多くの「リード化合物」が必要となる。また、プラントアクティベーターは30年以上前から実用されている薬剤だが、その詳細な作用メカニズムは、実はわかっていなかった。
植物は、病原体に感染した細胞が即座に自発的なプログラム細胞死を引き起こし、病原体を感染部位周辺に封じ込め、さらに周辺部位に抗菌物質を蓄積するという免疫メカニズムによって耐病性を発揮する。そこで研究グループは、この免疫メカニズムを利用した新たなプラントアクティベーターを探索する方法の開発に挑んだ。
研究グループは今回、モデル植物であるシロイヌナズナの「懸濁培養細胞」に薬剤と病原体を混合し、感染時に引き起こされるプログラム細胞死を、「多検体プレート」上で定量検定することで植物免疫応答を増強する薬剤を探索する方法を新たに開発した(画像2)。
同手法は、死んだ細胞を特異的に染める色素を使うことで、シロイヌナズナの培養細胞が病原体感染に伴って引き起こすプログラム細胞死を定量検定するというもの。化合物(薬剤)が免疫応答に及ぼす効果を調べることが可能だ。
培養細胞と病原体を一晩混合すると、細胞が死んで染色される。画像2の右側で番号で示されているように、同じ種類の薬剤を、病原体を添加した場合(病原体+化合物)とそうでない場合(化合物)とで同時に調べることで、同じプラントアクティベーターでも2タイプを識別することが可能だ。
その2種類は、病原体がなくても細胞死を引き起こす「植物免疫誘導型」と、病原体が感染した時に発動される免疫応答を増強する「植物免疫プライミング型」である。また、免疫応答としての細胞死を阻害する薬剤も同時に探索可能だ。この2種類を比較すると、植物免疫誘導型は継続的な免疫誘導による生長阻害を引き起こしてしまうが、植物免疫プライミング型はそうした副作用はなく、実用性の高いプラントアクティベーター開発のためのリード化合物として期待できるという。
実際に、さまざまな低分子有機化合物1万個からなる化合物ライブラリーを同手法で選抜し、得られた候補薬剤の類縁体群を解析した結果、5つの植物免疫プライミング型プラントアクティベーターを発見するに至ったという(画像3)。
共同研究グループは、発見した薬剤を構造分子の違いから2群に分類し、それぞれ「インプリマチンA(ImprimatinA)」、「インプリマチンB(ImprimatinB)」と名付けた。
次に、これらの薬剤をシロイヌナズナに添加したところ、病原細菌に対する耐病性が向上したのを確認(画像4)。この時、免疫応答を制御する植物ホルモン「サリチル酸」の内生量が上昇した一方、サリチル酸の代謝物「サリチル酸配糖体」が減少していることが確認された(画像5)。
画像4は、病原体を感染させた後の3日後の葉内細菌数。ImprrimatinAおよびBをシロイヌナズナの根から吸収させると(量は100マイクロモーラー:μM)、吸収させていない個体(コントロール)に比べて、葉に接種した病原細菌の葉内での増殖が抑制された。対照となるサリチル酸(50μM)と同程度の効果が観察された。
画像5は、病原体感染後24時間のサリチル酸内生量。通常であれば、病原体接種後の葉内では代謝によりサリチル酸量が減少し、サリチル酸配糖体が増加する(コントロール)。
しかし、薬剤処理によってサリチル酸量が増加し、一方でサリチル酸配糖体の量が減少していた。このことから、ImprimatinA、Bは、サリチル酸の代謝を阻害してサリチル酸の蓄積量を上昇させ、免疫活性化能を発揮していると予想されたのである。
また、ImprimatinAおよびBは、サリチル酸の配糖体化を進める既知のサリチル酸配糖化酵素「UGT74F1」と、新規に発見された「UGT76B1」の活性を阻害することも見出された(画像6)。詳細な解析により、ImprimatinAおよびBはサリチル酸の代わりに両酵素に取り込まれるため、サリチル酸配糖体が形成されないことが判明したのである。
さらに、遺伝子操作によりこの2つのサリチル酸配糖化酵素を欠損させた変異体を調べたところ、耐病性が向上して薬剤の作用が発揮された状態が再現された。つまり、植物の耐病性を向上させる1つの方法として、サリチル酸配糖化酵素を阻害することが有効だということがわかったというわけだ。
サリチル酸は、植物細胞内において非感染状態では少量だが、病原体感染に伴って増加して免疫応答を誘導すると共に、サリチル酸配糖体へと速やかに代謝される。したがって、サリチル酸配糖化の阻害によって病害感染時のサリチル酸量が増加し、より迅速で強力な免疫応答が誘導されることがわかった。
研究グループによれば、開発された薬剤探索法を利用すると、今回発見した薬剤以外にも副作用の少ないプラントアクティベーターの開発に向けたリード化合物の獲得が期待できるという。
また、サリチル酸配糖化酵素を阻害する薬剤を集中的に探索することで、さらに有望な薬剤が得られる可能性も期待できるようだ。そのため今後、サリチル酸代謝を感染時だけ抑制するような分子遺伝学的・生物工学的改変ができれば、病害耐性能を強化した作物の開発が期待できるとも述べている。