名古屋大学(名大)は、鉄を介した酸化ストレスによる動物発がんモデルにおいて、ヒトのがんと同様の染色体変化が再現されることを見出したと発表した。鉄を介した酸化ストレスが、人間の一般的ながんの普遍的な原因因子となっている可能性を支持する有力なデータであるとしている。
成果は、名大大学院 医学系研究科 生体反応病理学の赤塚慎也助教、同 豊國伸哉教授らの研究グループによるもの。研究の詳細な内容は、米国東部時間8月29日付けで米オンライン科学誌「PLoS ONE(Public Library of Science One)」に掲載された。
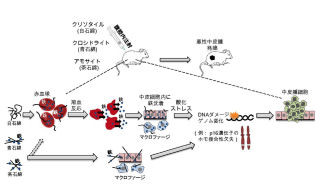
研究グループは、今より30年ほど前に、「鉄ニトリロ三酢酸」と呼ばれる鉄化合物をラットもしくはマウスの腹腔内に反復投与することで、高頻度に「腎細胞がん」が誘発されることを見出している。
この鉄化合物は「鉄キレート錯体」の構造を採っており、「ヒドロキシルラジカル」と呼ばれる毒性の高い活性酸素を生じる化学反応を促進する性質だ。その活性酸素生成反応は、ほ乳動物の体内では、腎臓の尿細管内で最も強く誘発される。研究グループは、この腎発がんモデルを「酸化ストレス誘発発がんモデル」として位置付け、その発生機構の解明に長年取り組んできた次第だ。
ヒトの一般的ながんの多くでは、がん細胞の核内ゲノムにおいて、染色体の脱落・増幅・転座および染色体数の異常などが認められる。染色体に関するこの異常は、「染色体不安定性」と呼ばれ、ヒトのがん細胞の一般的な形質と考えられているものだ。
染色体不安定性が発がんの機構に直接的にどう関わっているのかは、現在のところ詳しくは解明されていない。問題点は、それを研究するのに適した動物発がんモデルが今のところ見つかっていなかったことである。しかし研究グループは今回、染色体不安定性の結果と考えられるゲノム変化が、上記の鉄化合物誘発ラット腎がんにおいて生じていることを見出したというわけだ。
今回の研究では、鉄化合物誘発ラット腎がんにおける染色体コピー数変化をゲノム網羅的に解析するため、「アレイCGH(comparativegenomichybridization)」を施行した。アレイCGHとは、ゲノムDNAの増幅や欠損といったコピー数異常を、全ゲノムにわたって検出する方法のことだ。そして、13の原発腫瘍組織と2つの細胞株を解析した結果、ゲノム中に広範かつ多数のコピー数変化を含むものの割合が高いことが判明した(画像1)。
同モデルと比較する対象として、「Eker系統ラット」の腎がん(遺伝性腎がん)についてもアレイCGH解析を実施。Eker系統ラットの腎がんは生殖系列細胞の(世代間に伝わる)遺伝子変異によって生じるが、その腎がんゲノムでは、染色体レベルのコピー数変化は3例中1例しか見られず、その1例においても少数の染色体でしか広範なコピー数変化は起きていなかった。
実際、これまで全世界でアレイCGHを用いて解析された動物腫瘍のゲノムに関しては、遺伝子改変動物の場合を除いては、顕著な染色体変化は高頻度には見られていない。
ヒトの一般的ながんの多くが染色体不安定性の特長を有することを考えると、今回得られた結果は、ヒトの発がんにおいても、鉄を介した酸化ストレスが主な要因となっている可能性を示唆している。
すなわち、同発がんモデルはほかの化学発がんモデルと比べて人間の一般的な発がん過程との共通性が高く、発がん研究のための動物モデルとして有用であると考えられるというわけだ。
さらに、同モデルに共通的に見られる染色体変化の特長も検討された。画像2は、鉄化合物誘発ラット腎がんにおいて検出されたコピー数異常の13の原発腫瘍組織と2つの細胞株にわたって見られた頻度を、ゲノムの部位に沿ってプロットしたものである。
画像2は、ゲノムの各部位でのコピー数異常の発生頻度。上側の縦棒は増加(薄い赤の縦棒分)または増幅(濃い赤の縦棒分)と判定されたサンプルの割合を、下側の緑色の縦棒は減少(薄い緑の縦棒分)またはホモ欠失(濃い緑の縦棒分)と判定されたサンプルの割合をそれぞれ示したものだ。コピー数異常の頻度が高い部位に一致する2つのがん関連遺伝子座(MetおよびCdkn2a)の位置を、グラフ中に表示している。
この頻度解析により、同モデルに見られる染色体変化の2つの特長が明らかとなった。第1の特長は、整数倍体の状態からコピー数が減少している染色体部位の方が、増加している部位よりも多いというものである。
この特長は、ヒトの腎臓がんの中で最も一般的なタイプである「明細胞腎がん」のアレイCGH解析において、コピー数変化がより高度に蓄積されている標本群では、コピー数増加の部位よりもコピー数減少の部位の方が平均的に多くなっていたという事実とも一致する具合だ。
また、コピー数減少の様式としては、特定の染色体(ラット5/6/8/9/14/15/17/20番染色体)において、染色体1本全体あるいは染色体の半分以上の長い領域が失われるという変化が頻発するというものであった。
その中でも、5番染色体は特に減少が起こりやすい染色体の1つであり、「Cdkn2a遺伝子座」はこの染色体上にある。2つのがん抑制遺伝子を含むCdkn2a遺伝子座の欠失は、このような染色体単位での変化の傾向を背景として発生することが確認された。
そして第2の特長的な変化は、ラット4番染色体に特異的な染色体増幅だ。同染色体セントロメア側の長い範囲(50Mb以上)にわたってコピー数の増幅が高頻度見られ、頻度分布のピークは既知のがん遺伝子である「Met」の座位に一致していたという。
この増幅領域を含むラット4番染色体のセントロメア側80Mbは、人間の7番染色体と相同関係にある。人間の7番染色体は、「膠芽腫(こうがしゅ)」や「非小細胞肺がん」などの種々の腫瘍において高頻度に増幅が認められる。同モデルにおいては、原発腎腫瘍の大きさがMetの発現量と相関しており、Metが腫瘍の成長速度を高める因子として働いていることが示唆された。
さらに、全ゲノムの染色体変化パターンにより腫瘍サンプルの「階層的クラスター分析」を行うと、サイズの際立って大きい腫瘍の一群は、ほかとは独立した1つのクラスター(分類群)を形成したのである。すなわち、腫瘍の表現形質をゲノム変化の全体的な型と対応付けることができた。
これらの結果は、鉄過剰を介した慢性的酸化ストレスは、発がん刺激として作用すると、大きな染色体部位にわたる欠失や増幅を惹起し得るということを、動物個体レベルで初めて示したものであり、意義深いと考えられるという。
ヒトのがんに見られる染色体変化が、どのような過程を追って生じるかはまだ詳しくはわかっていない。それは、発がんという事象を決定付ける重要な過程である。同動物モデルを用いれば、その過程を始点から終点まで順次観察することが可能となるかもしれず、発がん原理の解明への貢献が期待されるとしている。
また、鉄はヒトにおいて最も多く含まれる重金属であり、その60%は赤血球の中のヘモグロビンにある。地球上には鉄なしで生存できる独立生命体はいないという。近年、ヒトにおいても、ウイルス性肝炎、アスベストによる中皮腫、卵巣の子宮内膜症に伴う卵巣がんなどで、過剰鉄が発がんの主要な原因になっていることがわかってきた。さらに、米国からは、鉄を体内から減少させる唯一の方法である「瀉血(しゃけつ)」を年2回行い5年間観察すると、発がん率が有意に下がったという報告もあるほどだ。
ヒトの長寿化に合わせて鉄の制御をすることが、がんの発生を予防したり、遅らせたりする効果があることが期待されるため、研究グループは今後、この方面の研究を推進する予定としている。