大阪大学(阪大)は、インターフェロンにより誘導されるタンパク質であるGBP(p65 GTO分解酵素)が寄生虫「トキソプラズマ」を破壊することでトキソプラズマ症の発病を抑制している宿主防御因子であることを明らかにした。同成果は、同大 医学系研究科の竹田潔 教授(免疫学フロンティア研究センター兼任)と同 微生物病研究所の山本雅裕 准教授(免疫学フロンティア研究センター兼任)らとスイス・ジュネーブ大学 医学部微生物学教室(ドミニク・ソルダーティ=ファーブル博士)の共同研究グループによるもので、米国の科学雑誌「Immunity」オンライン版に掲載された。
トキソプラズマはネコを終宿主とする病原性寄生虫で、中間宿主はヒトを含むほぼすべての恒温動物であり、ヒトに限っていえば全世界人口のうちの約3分の1が感染し、日本でも数千万人に感染していることが試算されている。
健常人では一過性の発熱などを除いてほとんど症状がないことからトキソプラズマは日和見病原体として扱われている、エイズ患者や抗がん剤を投与された患者などの免疫不全者においてはトキソプラズマ脳症を引き起こすことが知られている。近年、ガーデニングの流行や非加熱の生肉食の増加などのライフスタイルの欧米化に伴い、とりわけ妊婦がトキソプラズマに感染し、その結果胎児にトキソプラズマが母体の胎盤を介して感染し流産したり、あるいは新生児が水頭症に罹患した状態で生まれてくるなど予後不良な疾患を引き起こす症例が急増しており話題になっているほか、統合失調症の発病にもトキソプラズマの感染の有無が関連しているとの報告もされたりもしている。
トキソプラズマはマラリア症の原因病原体であるマラリア原虫などと同じ胞子虫類原虫に分類され、宿主の細胞の中でのみ増殖可能な偏性細胞内寄生生物。感染可能な細胞の種類はすべての有核の細胞であり、赤血球あるいは肝臓細胞のみにしか感染できないマラリア原虫とは比較にならないぐらいの多種多様の細胞がトキソプラズマの標的細胞となることが、多くの感染者がいる原因の1つであると考えられている。
トキソプラズマは細胞に感染した時に、「寄生胞」と呼ばれる細胞内小器官を形成し、その中で宿主から栄養分を摂取することで効率的に増殖することが分かっていり。それに対して、宿主はインターフェロン(IFNγ)というT細胞やナチュラルキラー細胞などの免疫細胞から主に分泌されるタンパク質を使って寄生胞内のトキソプラズマを破壊することがトキソプラズマ症の発病を防ぐのに重要であるということが約30年前から示唆されていたが、IFNγ自身には病原体を直接破壊するような構造はないため、どのようにしてIFNγがトキソプラズマを破壊しているのかについてのメカニズムは長い間不明のままであった。
|
|
|
図1 トキソプラズマは「寄生胞」の中で増殖する。(A)トキソプラズマの電子顕微鏡写真。(B)寄生胞の中で増殖しているトキソプラズマの電子顕微鏡写真。寄生胞膜を介して感染細胞から増殖に必要な栄養分を摂取する |
そこで研究グループは、IFNγがマクロファージや線維芽細胞などの自然免疫担当細胞に作用して、約2000種類のエフェクタ分子群の遺伝子発現を誘導することに着目して研究を行った。同群の中にはトキソプラズマの寄生胞の周辺に集まってくるGBP(p65 GTP分解酵素)と呼ばれる13個のファミリー分子群から形成されるエフェクタ分子群があり、宿主の抗トキソプラズマ免疫応答に何らかの役割を果たしていることが考えられていた。
通常、ある特定の遺伝子の役割を調べたいという場合には1つの遺伝子を欠損させたマウスを作成して検討するが、GBPの場合はそれぞれの遺伝子の相同性が非常に高く(よく似ているため)、1つの遺伝子を欠損させても非常に良く似た別のGBPファミリー分子がその機能を補う(相補する)ことが予想されたことから、研究グループではGBPファミリー分子が6個と7個に分かれて異なる染色体上の非常に狭い領域に隣り合って存在することを利用して、染色体工学的手法を用いて3番染色体上に存在するすべてのGBP(6個)のGBPファミリー分子を欠損するマウス(GBPchr3欠損マウス)の作製し解析を行った。
GBPchr3欠損マウスと野生型マウスにトキソプラズマを感染させ生存率を測定した結果、GBPchr3欠損マウスはトキソプラズマ感染に対して非常に弱くなっていることが判明した。また感染マウス内でのトキソプラズマの感染拡大を、トキソプラズマから出る発光を指標に生体イメージング装置を使って検討したところ、GBPchr3欠損マウス内では野生型マウスと比べて劇的にトキソプラズマが増殖していることが判明した。
次にトキソプラズマが生体内で感染している細胞であるマクロファージを単離して、トキソプラズマを感染させその増殖を検討したところ、IFNγで野生型マクロファージを処理すると濃度依存的にトキソプラズマの増殖が抑制されるが、GBPchr3欠損マクロファージではIFNγによるトキソプラズマの増殖を野生型細胞と比較して抑制できないことを見出した。このことから、IFNγによって誘導されるGBPchr3は自然免疫細胞マクロファージ内でトキソプラズマ増殖を妨げることが、生体レベルでのトキソプラズマに対する感染防御反応に重要であることが判明した。
この結果を受け、研究グループでは「何故、GBPを欠損したマクロファージではトキソプラズマの増殖を抑制できないのか」という問題を解決するために電子顕微鏡を用いて、感染細胞内でのトキソプラズマの状態を検討したところ、IFNγで刺激した野生型マクロファージ内ではトキソプラズマの寄生胞の膜が激しく波打ち、その構造が著しく破壊されていることを確認したものの、GBPchr3欠損マクロファージ内ではIFNγ処理をしてもそうした寄生胞膜の構造変化は確認できなかったという。このことから、GBPはマクロファージ内でトキソプラズマの寄生胞の膜構造を破壊する機能があることが判明した。
|
|
|
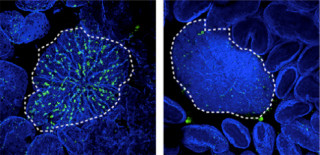
図3 GBPchr3を欠損した細胞では寄生胞膜の構造変化が認められない。(A)野生型。(B)GBPchr3欠損マクロファージにおける寄生胞内のトキソプラズマの電子顕微鏡像。野生型細胞では寄生胞の膜が激しく波打っているのに対し、GBPchr3欠損細胞ではそのような変化は認められない |
こうした結果から、どのようにしてGBPはトキソプラズマの寄生胞膜を破壊することができるのかをさらに検討し、以前から寄生胞膜の破壊についての機能が示唆されていたGBPとは別のファミリー分子群であるp47 GTP分解酵素(IRG)の動態について、野生型およびGBPchr3欠損マクロファージで比較したところ、野生型細胞ではIRGがトキソプラズマに蓄積するのに対して、GBPchr3欠損マクロファージではIRGの蓄積が著しく減少していることが判明した。またGBPとIRGの局在について野生型マクロファージ内で検討したところ、どちらもトキソプラズマに蓄積し、さらにGBPはIRGに結合していることも判明した。
|
|
|
図4 GBPchr3を欠損した細胞ではIRGのトキソプラズマへの蓄積が低下している。(A)IRGのトキソプラズマへの蓄積を比較したところ、野生型細胞に比べてGBPchr3欠損細胞ではIRGとトキソプラズマが共局在している像が認められない。(B)野生型細胞においてGBP、IRGとトキソプラズマは共局在をすることからGBPとIRGは非常に近い所に存在することが示唆された |
これらのことから、GBPはIRGをトキソプラズマに蓄積させることでその寄生胞膜を破壊し増殖を阻害していることが示唆されるに至ったという。
今回の研究により、IFNγによって誘導される抗トキソプラズマ感染防御機構にGBPが重要な役割を果たしていることが明らかとなり、これにより人為的にGBPの機能を高めることで、トキソプラズマ症に対する新たな治療戦略を提供できることが期待されると研究グループではコメントしている。
また、寄生胞はトキソプラズマに限らずマラリア原虫においても形成されることを考えると、GBPがマラリア原虫感染防御に関与する可能性は非常に高く、マラリア症の発病におけるGBPの役割の解明は最も重要な今後の研究課題となるほか、GBPはさまざまながんにおいて高い発現が認められることが多数報告されていることから、感染下ではない異常な状態でのGBPの存在が引き起こす疾患の病理機構の解明に、今回作り出されたGBP欠損マウスが有用であると考えられるともコメントしている。