理化学研究所(理研)と国立がん研究センターは6月6日、乳がん患者に投与した抗がん剤の体内での動きをPET(陽電子放出断層画像法)検査で調べ、治療の効果や転移の有無について従来とは異なる体を傷つけず(非侵襲的)に診断する手法を開発したと発表した。
成果は、理研 分子イメージング科学研究センター 分子プローブ動態応用研究チームの渡辺恭良チームリーダー、国立がん研究センター中央病院の田村研治医長らの共同研究グループによるもの。研究の詳細な内容は、6月5日に米国シカゴで開催される第48回米国臨床腫瘍学会(Annual Meeting of the American Society of Clinical Oncology)で発表された。
日本における乳がん罹患率は増加しており、女性の部位別のがん罹患率第1位となっている(出典:全国がん罹患モニタリング集計2007年)。現在では、手術後に化学・ホルモン療法を組み合わせることで、以前よりも高い生存率を得られるようになってきた。しかし、肺、肝臓、骨などほかの臓器への転移や再発率が高く、乳がんの難治性の要因として挙げられている。
乳がん症例の20~30%は、乳がん細胞の表面に「HER2タンパク質」と呼ばれる受容体タンパク質を多く持つHER2陽性乳がんだ。このHER2タンパク質が乳がんの増殖や転移に関与していると推測されている。
1998年、このHER2タンパク質を狙い撃ちする抗体医薬「トラスツズマブ」(商標名:ハーセプチン)が米国で認可(日本では2001年)され、乳がん治療を大きく変えた。トラスツズマブは、HER2タンパク質に結合して乳がん細胞の増殖を抑えるため、HER2タンパク質やHER2遺伝子を過剰に持っているHER2陽性乳がんに対して、高い治療効果を示すのである。
乳がん患者がHER2陽性かどうかを調べる現時点で最も確実な方法は、針生検で侵襲的にがん組織を採取し、生化学的な方法で細胞を検査することだ。しかし、がん組織の正確な採取が技術的に困難なことや、がんの進行や治療の経過に応じて針生検を複数回行うことが必要で、患者にとって大きな苦痛となっている。そのため、針生検に替わる非侵襲的でより正確なHER2陽性乳がんの検査方法の確立が期待されている状況だ。
現在、乳がんをはじめ、一般的ながんの早期発見に用いられているPET検査(FDG-PET)は、痛みを伴わずに悪性の腫瘍か良性の腫瘍かを見分ける方法として広く普及している。しかし、FDG-PETではがん細胞の詳しい情報を得られず、患者適合性の検査には応用することができない。
そこで研究グループは、診断と治療を同一薬剤で実施する「セラノスティックス」の考え方に基づき、トラスツズマブそのものをPETプローブとして用いて、体内のHER2陽性がん細胞を非侵襲的に画像診断する手法の開発に取り組んだ次第だ。
トラスツズマブの分子イメージングには、放射性同位体「インジウム111(111In:半減期2.81日)」を用いた「SPECT(Single Photon Emission Computed Tomography:単光子放出断層画像法)」、放射性同位体「ジルコニウム89(89Zr:同3.25日)」を用いたPET検査の先行報告がある。
これらの例では、トラスツズマブが腫瘍組織に蓄積するのに多くの時間がかかることを考慮し、FDG-PETで用いる「フッ素18(18F:同110分)」よりも著しく半減期の長い放射性同位体が使用された。また得られた診断画像の解像度も低く、検査の確実性、被曝量などの安全性が課題とされている。
研究グループは、より半減期の短い放射性同位体「銅64(64Cu:半減期12.7時間)」を用いる新しいPETプローブ「カッパー64・ドータ・トラスツズマブ(64Cu-DOTA-Trastuzumab)」を作製。
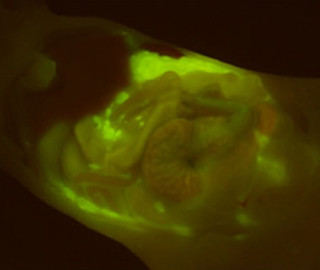
64Cu-DOTA-Trastuzumabが生体内のHER2陽性細胞を検出できるかどうかを調べるため、HER2発現量の異なる2種類のヒト腫瘍を移植したマウスでPET検査を実施した。すると、移植腫瘍にHER2の発現量を反映した強さのシグナルを認め、PETプローブとしての有用性を確認(画像1)。
また、PET撮像後に取り出した移植腫瘍の顕微鏡観察からも、64Cu-DOTA-TrastuzumabがHER2陽性細胞に結合していることが確認されたのである。
画像1は、ヒト腫瘍移植マウスにおけるトラスツズマブPETプローブの集積の様子だ。マウスにHER2発現レベルの異なる2種類のヒト腫瘍細胞を移植し、64Cu-DOTA-Trastuzumabを用いてPET撮像したところ、HER2発現量の高い腫瘍に顕著なシグナルを観察し(赤丸)、HER2発現量の低い腫瘍では弱いシグナルを観察した(白丸)。なお胴体部の緑の部分は、肝臓への非特異的な蓄積によるもの。
臨床試験では、すでにHER2陽性であることが確認され、トラスツズマブで治療中の乳がん患者の協力を得た。文書による臨床試験への参加同意が得られた患者14症例に対して、通常治療用量の100分の1以下に相当する64Cu-DOTA-Trastuzumabを静脈注射し、6、24、48時間後にPET検査が実施された。
その結果、最小直径2.0cmまでの腫瘍を描出できることが判明し、ほとんどの症例でHER2陽性乳がんの原発巣に一致したシグナルが観察されたのである(画像2)。
画像2は、HER2陽性乳がん原発巣におけるトラスツズマブPETプローブの集積の様子。トラスツズマブを用いる術前化学療法中のHER2陽性乳がん患者に64Cu-DOTA-Trastuzumabを静脈注射しPET検査したところ、左乳房の原発巣の位置に一致したシグナルが観察された(矢頭)。左下の赤い部分は血中のシグナル(心臓内腔)を示す。
|
|
|
画像2。HER2陽性乳がん原発巣におけるトラスツズマブPETプローブの集積の様子 |
転移巣の診断では、特に脳転移の描出に優れることがわかった(画像3)。針生検でHER2陽性乳がんの肺転移が確定した症例では、転移巣の位置にシグナルを認め、針生検と画像診断の結果が一致することが確認された形だ(画像4)。
|
|
|
|
HER2陽性乳がん転移巣でのトラスツズマブPETプローブの集積。H64Cu-DOTA-Trastuzumabの体内動態を全身にわたって追跡したところ、3症例で脳転移が疑われるシグナルを観察したのが、画像3(左)の矢頭。また、針生検で肺転移が確定した患者では、肺転移巣に一致したシグナルを観察したのが、画像4の矢頭。写真右の中央部の赤い部分は血中のシグナル(心臓内腔)を示す |
|
また胸骨/縦隔リンパ節転移症例では、治療に伴いがん組織が縮小する様子を追跡することに成功した(画像5)。さらに、腎細胞がんとHER2陽性乳がんの両方のがんを有する症例(重複がん)では、HER2陽性脳転移巣が描出される一方、腎細胞がんではシグナルを認めず、今回のPET検査がHER2陽性腫瘍を特異的に検出することもわかったのである。
画像5は、トラスツズマブPETプローブで経過観察したトラスツズマブ治療の効果の様子。胸骨及び縦隔(左右の肺と胸椎、胸骨に囲まれた部分)に転移したHER2陽性乳がん患者に対するトラスツズマブ治療の効果を、64Cu-DOTA-Trastuzumabのシグナルで追跡した。
治療が進むにつれて、HER2陽性腫瘍の縮小を確認した(白丸で囲んだ領域)。その下部は心臓内腔のシグナルを示す。左:治療前、中:治療第8サイクル(8週間)後、右:治療第16サイクル(16週間)後。
今回のPET検査による被曝量は約5.3mSvであり、現在の標準的なPET検査(FDG-PET)の被曝量(約6.7mSv)とほぼ同等なことから、一般病棟や外来で実施可能な診断法として実用化が期待できるという。
また、PETプローブとして投与した抗体量も53~87μg(平均73.5μg)であり、生体に影響を及ぼさない1mg以下という超微量でも十分に撮像できることがわかっている。
さらに64Cu-DOTA-Trastuzumabは、原則、PET検査室を持つ医療施設であれば、どこでもHER2陽性乳がんの画像診断が可能だ。今後は、HER2陰性を含めた複数の乳がん患者の協力を得て臨床研究を重ね、実用化を目指すとしている。
そして、分子標的薬の患者適合性を検査するため、薬そのものをPETプローブ化し非侵襲的な画像診断を行う方法論は、トラスツズマブ以外の抗体医薬についても応用可能だ。
理研分子イメージング科学研究センターは現在、大腸がんの抗体医薬セツキシマブ(商標名アービタックス)のPETプローブ化に成功し、すでに動物実験での有効性を確認している。これらの臨床応用により、さまざまながんの個別化医療を推進するとした。