慶應義塾大学(慶應大)は3月28日、マウスおよびヒトの「線維芽(せんいが)細胞」にiPS細胞を作る4つの因子(Oct4、Sox2、Klf4、cMyc)を導入した後、iPS細胞を作らずに特別な「神経幹細胞(diNSC:directly induced neural stem cell)」を誘導する条件で培養を行ったところ、約2週間で実際に神経幹細胞を作成することに成功したと発表した。
またこの神経幹細胞は、iPS細胞やES細胞から誘導した神経幹細胞に比べて極めて速いスピードで分化成熟するため、培養条件を工夫することにより、分化しにくく腫瘍のもとになる細胞と区別して培養することが可能になることも併せて発表された。
成果は、医学部生理学教室の赤松和土講師、岡野栄之教授らの研究グループによるもの。研究の詳細な内容は、米国東部時間3月28日付けで米オンライン科学誌「Stem Cells」に掲載された。
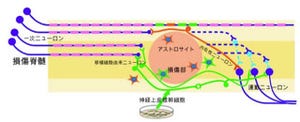
神経幹細胞は、ニューロンおよびグリア細胞(神経系を構成する神経細胞ではない細胞の総称でありアストロサイト、オリゴデンドロサイト、シュワン細胞などを含む)へ分化する細胞を供給する能力を持つ神経系の幹細胞だ。脊髄損傷や神経変性疾患などの難病に対して行う細胞移植のソースとして有効であることが期待されている。iPS細胞が開発されたことで、患者本人から作ったiPS細胞から神経幹細胞を誘導することが可能になり、自分の細胞を治療に使用できる「自家移植」が行えるようになるというわけだ。
しかしながら、現在の技術では、患者自身の細胞からiPS細胞を経て神経幹細胞を作成するのに、2カ月から半年と長い期間を要してしまっている。それに加えて、iPS細胞は細胞の株ごとに安全性や分化の方向性が大きく異なることがわかっており、安全なiPS細胞であることを検証するには、さらに長い期間を要するのが現状だ。
さらに、脊髄損傷においては、患者の症状が固定する前に神経幹細胞を移植しないと効果がないことが明らかになっており、動物における実験の結果から推測すると、その期間は受傷後約2~4週間以内と考えられている。
そのため、このように細胞移植が有効な期間が限られる疾患では、iPS細胞の移植技術を用いても患者本人の細胞を治療に使うことは難しいのではないかと考えられてきた。
そこで研究グループは、この問題を解決するために、患者自身の細胞から短い時間で安全な神経幹細胞を得る方法を検討した次第である。
今回、マウスの線維芽細胞にiPS細胞を作る4つの因子を導入した後、iPS細胞を作らずに神経幹細胞を誘導する条件で培養を行ったところ、約2週間で神経幹細胞を含む細胞集団である「ニューロスフェア」(神経幹細胞を含む球状の神経系細胞の塊。神経幹細胞を浮遊培養で継代培養する方法として用いられる)が誘導された。
さらに培養条件を改良することにより、約2週間の培養で元の線維芽細胞の約100倍の量の神経系の細胞を誘導することが可能なことが確認されたのである(画像1)。
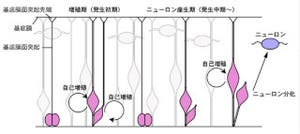
この神経幹細胞のdiNSCは、従来のES細胞やiPS細胞から誘導された神経幹細胞とは異なり、「グリア細胞」(アストロサイトやオリゴデンドロサイト)を多く産生する成熟型の神経幹細胞に極めて速いスピードで分化することが判明した。
diNSCは、胎児の線維芽細胞、成体の線維芽細胞など、元の細胞の種類によって性質が少し異なるが、成体の線維芽細胞から誘導した場合、最も高い効率で成熟型の神経幹細胞が誘導されたのである(画像2・3)。
|
|
|
|
画像2(左)は、成体線維芽細胞から誘導された神経幹細胞の分化像。画像3は、ES細胞から誘導された神経幹細胞の分化像。図の緑は神経細胞を、赤はグリア細胞を示しており、画像2と3を比較して、画像2の方がグリア細胞が多く産生されていることがわかる |
|
これまで脊髄損傷モデル動物への細胞移植実験では、成熟型の神経幹細胞は、未熟な神経幹細胞に比べて治療効果が高いことが示されており、ES細胞やiPS細胞から誘導した神経幹細胞は、成熟型の神経幹細胞へと変化させるために、さらに数週間の培養を加えていましたが、今回の方法ではその必要がないという点も大きなメリットだ。
iPS細胞から誘導した神経幹細胞は、神経幹細胞を作り出す能力が悪い細胞を含む場合が多く、特に成体の線維芽細胞から誘導した場合はそのような細胞を多く含むことが知られている。このような細胞はiPS細胞に似た状態のまま存在し続け、生体内に細胞集団を移植した後で腫瘍を形成するもとになることも既知の事実だ。
今回の方法で得られた神経幹細胞の集団は、途中まではiPS細胞の誘導と同じ操作をしているため、iPS細胞に似た性質を持つ細胞が含まれている可能性はあるという。しかし、極めて速く分化する細胞が多いため、成長因子「EGF(Epidermal Growth Factor)」(細胞の成長と増殖の調節に重要な役割を担い、最も成熟したタイプの神経幹細胞を増殖させる能力がある)を用いると、iPS細胞に似た性質を持つ細胞は生存できず、成熟した神経幹細胞のみが生存できるような培養条件で増幅させることが可能だった。
その結果、今回の方法で得られた神経幹細胞には、腫瘍のもとになるような多能性を有する細胞は、1万個に1個以下という割合に抑えられたのである。これは、この方法がiPS細胞を経由して神経幹細胞を誘導するよりも安全な細胞を誘導できることを示唆する結果だ。
この方法は、ヒト線維芽細胞(画像4)においても応用することが可能であり、ヒトの皮膚から採取し培養した線維芽細胞からも、神経幹細胞を含む細胞集団であるニューロスフェアを誘導することに成功している(画像5)。
このニューロスフェアは線維芽細胞に4つの因子(Oct4、Sox2、Klf4、cMyc)を導入後約18日間で誘導されており、そこからニューロンやグリア細胞が誘導されたことから、神経幹細胞を含んでいることが確認された。これまでヒトiPS細胞を得るのに2カ月程度、そこから神経幹細胞を誘導するのに1-2カ月を要していたことを考えると、誘導に必要な期間を大幅に短縮したといえるだろう。
今後の再生医療において、患者本人の細胞から採取して樹立したiPS細胞は、神経幹細胞を得て患者本人の治療に使えると期待されている。しかしながら、脊髄損傷など細胞移植が有効な期間が限られる疾患では、いかに迅速に患者本人の細胞を準備できるかということが、自家移植の実現のためには重要となることは前述した通りだ。
今回の結果では、ヒト細胞においても線維芽細胞から約2週間で神経幹細胞を得ることに成功しており、現在の方法では諦めざるを得なかった自家移植の可能性に大きな期待が得られる結果だ。
今後はこの方法で得られたヒト神経幹細胞のさらなる安全性や有効性を検討し、将来の自家細胞移植治療の臨床研究へと繋げていきたいと考えていると、研究グループはコメントしている。