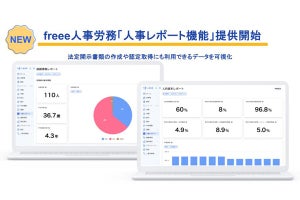
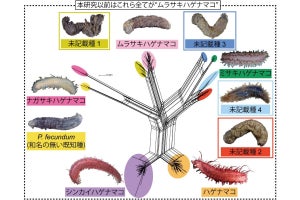
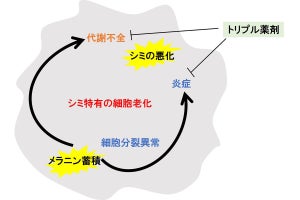
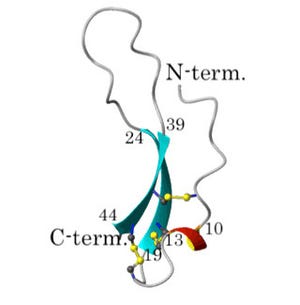
科学技術振興機構(JST)は、JST課題達成型基礎研究の一環として、米ワシントン大学 生物学部の鳥居啓子 教授(ハワードヒューズ医学研究所 正研究員 兼任)らが、異分野融合により新規に技術開発を行い、植物表皮において気孔の数を抑制する機構を分子レベルで明らかにしたと発表した。同研究は、ワシントン大学 生物学部のジンスク・リー博士研究員ら、および、同大 材料科学工学部のメフメット・サリカヤ教授、ジャンダン・タメルラー特任教授らと共同で行われたもの。研究成果は、2012年1月12日(米国東部時間)、米国科学誌「Genes & Development」のオンライン速報版に研究課題名「植物表皮組織における気孔パターン形成の動的ネットワーク」として掲載された。
植物の気孔は、大気中の二酸化炭素を効率よく取り込む通気口で、植物の光合成による物質生産や大気環境に大きな影響を与えている。
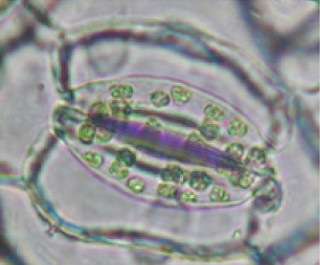
陸上植物の表皮組織、特に葉の裏に多く存在する気孔(図1)は、水や二酸化炭素の通気口であり、気孔口の開閉により植物の光合成や呼吸といった活動を制御している。このため、気孔のふるまいは陸上植物の繁栄、生存や、地球レベルの大気環境にも大きな影響を与える。この気孔が正常に開閉するためには、気孔の形成段階において数、密度が適切に制御され、葉の一面に均等に散在するパターンが形成される必要がある。
モデル植物として用いられるシロイヌナズナを含めた双子葉植物では、葉など光合成器官の発生過程において、未分化な表皮細胞の一部が非対称分裂を起こすことにより気孔の形成が開始される。
気孔の形成には「促進」と「抑制」の2つの制御機構があることが知られ、このうち抑制制御に関わる分子として、生体内で情報を伝達する分子「ペプチドホルモン」やその受容体の候補が知られていたが、それらが実際に結合して情報(シグナル)伝達するかどうかは、ペプチドホルモンの構造が複雑なことや、細胞内の転写翻訳機構が複雑であることなどから、分かっていなかったと言う。
例えば、気孔を形成する前駆体細胞は2種類のペプチドホルモンEPFとEPF2を分泌していると考えられている。この因子が、隣接する表皮細胞で発現しているERECTAファミリー受容体型キナーゼ(ERECTA受容体、ERL1受容体)およびTMMと関連して、気孔の数と分布を調節し、無制限に作られないようにしていると考えられてきた。
しかし、ペプチドホルモンにしても受容体にしても、あくまで気孔形成を抑制する因子の「候補」に過ぎず、これらペプチドホルモンが本当に受容体と結合するのか、また結合する場合にはどのペプチドホルモンが受容体に対応するのか、さらには、どのような相互作用により気孔のパターンが生じるのかなど分かっていなかった。
これらの解析が遅れていた背景として、EPFホルモンは複雑な立体構造を作るために活性のある状態での大量生産が困難であること、ERECTA受容体、ERL1受容体などのERECTAファミリー受容体型キナーゼ遺伝子は複雑な転写翻訳制御を受けており、植物以外の細胞で安定に作ることが難しいこと、などがあったと言う。
鳥居教授らは、まず候補となっているペプチドホルモンと受容体が、生体中で結合するかどうか調べるために、目印を付けた3種類のシロイヌナズナ受容体(ERECTA、ERL1、TMM)および2種類のペプチドホルモン(EPF1、EPF2)をタバコ表皮細胞に導入。そして、生化学的手法(免疫共沈降法)により、これらのペプチドホルモンがERECTA受容体とERL1受容体に強く結合すること、その一方でTMM受容体への結合は限られていることを発見した。
次に、詳細な解析を進めるため、大腸菌で生産したペプチドホルモン(EPF1、EPF2)をうまく巻き直す手法の開発に成功し、活性を持つ正しい形のペプチドホルモンが大量に得られるようになった(ペプチドが生物活性を持つには、細胞内でまずアミノ酸の鎖として作られた後、正しい形に巻かれる必要がある)。
この活性EPF1ホルモンとEPF2ホルモンをシロイヌナズナ植物表皮に散布すると、EPF1ホルモンは気孔の前駆体細胞の分化を阻害し、EPF2ホルモンは気孔になる細胞集団を作る最初の細胞分裂を阻害する、という生物活性を示した。
次に、ワシントン大学と共同で、ペプチドホルモンと受容体の結合を生体外で詳しく解析するため、植物から精製したERECTA受容体、ERL1受容体、TMM受容体をそれぞれ固層化した「受容体バイオセンサチップ」を開発(図2)。
QCM(水晶天秤)、表面プラズモン共鳴(SPR)という2つの解析技術を用いて、各々のチップ上に活性EPF1ホルモンと活性EPF2ホルモンを投与することにより、ERECTAファミリー受容体型キナーゼ(ERECTA、ERL1)がEPF1ホルモンとEPF2ホルモンと高い親和性を持って結合することを明らかにしたほか、TMM受容体はEPF1ホルモンとの結合能力はないものの、EPF2ホルモンとは結合可能という結果を得た。
さらに、ERECTAファミリー受容体キナーゼは、植物内でホモ2量体およびTMM受容体とのヘテロ2量体を作る一方、TMM受容体はホモ2量体を作らないことを明らかにした。一般にERECTAファミリー受容体型キナーゼやTMM受容体は、ホモ2量体を形成することで活性化することから、ERECTAファミリー受容体型キナーゼがEPFホルモンの受容体であり、TMM受容体はシグナル受容と伝達を調節する役割を持つことが示唆された。
これらの結果からEPF1ホルモンとEPF2ホルモンがERECTAファミリー受容体部位に直接結合することが明らかになったが、その一方で、生体内で実際にどの受容体がどのペプチドホルモンに結合してシグナルを伝達するのかが分かっていなかった。
そのため、鳥居教授らは、不活性なERECTA受容体とERL1受容体(ドミナントネガティブ型受容体)を発現させた植物体を作り、植物体内でそれぞれの受容体由来のシグナル伝達を選択的に阻害したところ、ERECTA受容体を阻害した植物は活性EPF2ホルモンを認識できなくなり、ERL1受容体を阻害した植物は、逆に活性EPF1ホルモンを認識できなくなったという。
これらの結果から、EPF2-ERECTA1、そしてEPF1-ERL1というリガンド(ホルモン)-受容体のペアが、気孔形成の開始と気孔前駆体細胞の分化という2つの重要なステップを制御していることが判明した(図3)。
今回の成果により、今までその理解されていなかった気孔パターン形成のシグナル受容メカニズムが明らかとなったが、これは受容体バイオセンサチップの開発や活性ペプチド大量生産など、植物科学と生化学・ナノバイオマテリアル科学という異分野の融合によってもたらされたものだと言う。
鳥居教授は今後、気孔形成の2つのステップを制御することが可能になると考えられ、乾燥耐性や二酸化炭素吸収に優れたバイオマス作物開発の可能性も示唆しているほか、ペプチドホルモンを農薬として安価に大量生産することで、遺伝子組換えを介さない、塗布による作物の生産性、乾燥耐性を制御する技術への応用も期待されるとしている。