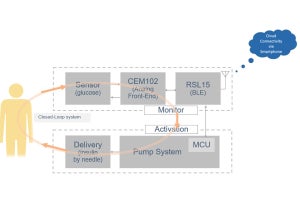
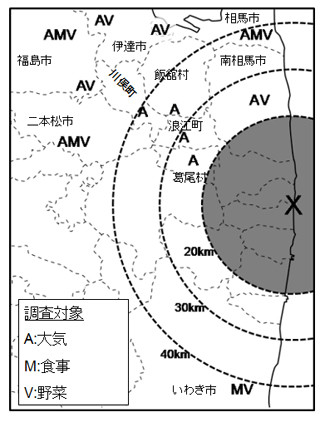
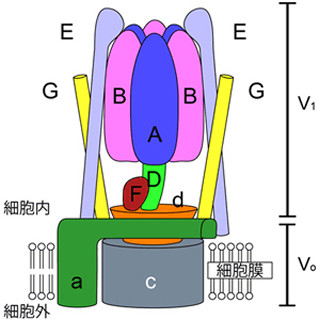
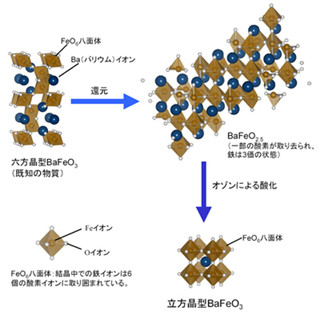
京都大学の研究チームは、体細胞レベルのDNA組換えである体細胞超突然変異somatic hypermutation(SHM)に対し、正常なDNAのらせん構造を維持する機能を持つTopoisomerase I(Top1)がactivation-induced cytidine deaminase(AID)活性化の下流で働くこと、および転写の活性化や抑制がTop1の作用を支配することを解明した。同成果は同大医学研究科免疫ゲノム医学講座の本庶佑 客員教授、および小林牧 同特定准教授らによるもので、「米国科学アカデミー紀要(PNAS)」に掲載された。
個体においてある特定の病原体や外来異物に対する免疫反応が記憶されるしくみは、免疫グロブリン遺伝子に体細胞レベルの遺伝子組換えが起きること、こうして生じた特異的な抗体を産生するB細胞が保持されることにより成り立っている。その体細胞レベルのDNA組換えである体細胞超突然変異SHMとクラススイッチ組換えclass switch recombination(CSR)、遺伝子変換gene conversionが起きるためには、いずれもAIDの発現と変異または組換えの起きる遺伝子部位の転写が必須である。
これら遺伝子組み換えのいずれにおいても最初の段階はDNAの単鎖切断であるが、AIDはシチジン-デアミナーゼ活性を持つものの直接DNAを切断する活性は持たず、AIDがいかなる作用によりDNAを切断するのかということについては長年の謎となっていたが、研究チームでは2009年にCSRに対してTop1がAIDの活性化を受けてDNA単鎖を切断することを示していた。
SHMを起こす培養細胞においてもCSRの時と同様、AIDの活性化がTop1たんぱく質の量の減少を引き起こしている。今回の研究においては、培養細胞におけるTop1のノックダウンやTop1のヘテロ接合体マウスB細胞ではSHMが促進され、逆にTop1を過剰発現させた際には減少したことから、Top1の量がSHMを制御することが示されたほか、Top1の特異的阻害剤であるカンプトテシンは体細胞超突然変異を抑制し、Top1の作用がDNA切断に必要であることを示した。
また、変異を起こす遺伝子の転写を徐々に抑制すると、たとえTop1をノックダウンした状態でも体細胞超突然変異は同様に徐々に抑制されていき、変異を起こす遺伝子部位の転写状態が大きくTop1の作用を支配していることが判明した。
大腸菌から高等真核生物までのいずれにおいても、Top1が減少するとDNAは正常構造(B構造)ではなく、ヘアピン=ループ構造のような複雑な2次構造(non-B構造)をとりやすくなる。
今回の結果は、AIDがTop1の減少を介して、切断がおきやすくなるようなDNAの構造変換とそれに続くDNA切断頻度の上昇をもたらしていることを示すものである。転写が活発でしかも2-3bpの繰り返し配列の部位に変異や欠失が起きることは、酵母などの実験系のみならず、神経疾患におけるトリプレットリピート病の繰り返し配列においても知られており(Transciption associated mutagenesis:TAM)、しかも、双方ともTop1がその切断酵素として作用することが2011年に発表されており、今回の研究はB細胞におけるAIDが、これらの活発な転写に伴う遺伝子変異機構という生物に普遍的な仕組みを利用して、免疫記憶の獲得を成し遂げていることを示す結果となった。
なお、AIDは感染などによる慢性炎症性刺激に伴う発がんに関わることが近年注目されており、今回の研究を通じて、AIDの下流においてTop1が遺伝子変異につながるDNA切断をもたらすことが明らかになったことから、Top1の制御を通じて腫瘍発生の頻度を下げるような新たな抗腫瘍戦略を開発できる可能性が開けたと研究チームでは説明している。