慶應義塾大学の医学部耳鼻咽喉科学教室(小川郁教授)、藤岡正人助教と生理学教室(岡野栄之教授)は、米ハーバード大学医学部(アルバート エッジ准教授)との共同研究により、実験者が選んだ細胞に特異的に、しかし一部分のみを観察者の好きなタイミングで細胞死に導くことのできる遺伝子改変マウスの作成に成功したことを発表した。同成果は米医学誌「The Journal of clinical investigation」オンライン版に掲載されたほか、6月1日発行予定の紙媒体(本誌)にも掲載される予定。
難病や変性疾患の多くで、原因の如何に関わらず特定の細胞が徐々に減っていくことで病気が進行していくことが知られている。これらの疾患では一般に症状が出る前から徐々に病勢が進行しているが、各臓器が元来持っている予備能(余剰能力)のおかげで細胞数が減っても最初のうちは臓器全体としての機能が保たれるため、結果的に症状が出るのは病気がある程度進行してからとなる。
定期検診の発達している日本では「早期発見・早期治療」の重要性が比較的早くから唱えられており、そのための研究として疾患早期の状態を詳細に検討する安定した動物実験モデルの樹立が急務であった。しかし、バラつきを小さく安定して少ない量の細胞死を誘導することは技術的に難しく、標的細胞がモザイク様に細胞脱落「しはじめた」状態を再現する動物モデルは従来、ほぼ皆無であり、実際、疾患モデルの多くはダメージの非常に進行した状態の再現であるか、時間と労力をかけて精緻に作り上げられた部分的障害モデルかで、特に後者は実験の準備期間が長くなってしまうことに加え、精緻なため施設間での微妙な差異が再現性に影響を与える場合もあり、結果としてダメージの小さな疾病早期を簡便に研究する上での障壁となっていた。
今回、研究グループでは、ベッドサイドでの「症状の起きはじめ(onset)」を簡便に再現し、疾患初期の病態生理を簡便に解析するツールとして、実験者が観察したい細胞や組織に限定して一定の割合で薬剤依存的にアポトーシス(細胞死)を起こす遺伝子改変動物を樹立した。
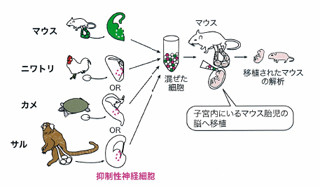
細胞種特異的な遺伝子発現コントロールには一般にCre/lox系が汎用されており、世界で数百種存在する細胞種特異的Cre発現マウスのライブラリから観察したい細胞にCreを持つマウスを選ぶことで標的細胞を決定させる。今回はさらに、この変法で異なるlox配列にstop配列を挟んだモザイク様発現を誘導する遺伝子発現調節カセットとFK506アナログ剤(AP20187:ARIAD製)投与で活性化される改変型自殺遺伝子カスパーゼ3を組合わせて時空間調節性のモザイク様細胞死誘導遺伝子(Mos-iCsp3)を作成し、次いでこの遺伝子を全身に発現させるトランスジェニックマウスを作成する方法を採用した。
|
|
|
図3 モザイク様の遺伝子発現カセット。Creリコンビナーゼ(Cre)とはloxと呼ばれる配列群を認識してlox間を組換え、間の配列を切り出す酵素。今回はその変法として相異なるlox間でのリコンビネーションを用いることで、下流の遺伝子発現のスイッチがONになる細胞とならない細胞をモザイク様に誘導している。この決定は確率論的に決まっているものと考えられるという |
同方法では、数百あるCreマウスの中から交配相手を選ぶだけで、観察したい疾患を選べ、選んだ細胞種の内どの細胞で実際に自殺遺伝子が発現されるかはCre/loxによるリコンビネーションで確率論的に決まり、細胞死は生物の体内で実際に起こる「アポトーシス」による、といった利点がある。特に細胞死がアポトーシスによることは、従来の遺伝子を用いた細胞死誘導の多くが実際の疾患とは無関係な毒素(ジフテリア毒素など)の発現による細胞死だったことと比較して、より生理的であるという大きな利点を持っており、同技術に関しては現在、減米国特許の申請中だという。
研究グループでは、このMos-iCsp3マウスを3つの異なるCreマウスと交配し、3つの疾患の初期の再現を試みた。その結果、病気の起きはじめの段階では、細胞死の量だけではなく、各組織の再生能も特に重要な因子となることが観察されたという。1つ目の疾患は、「膵臓β細胞の部分的脱落による耐糖能異常(糖尿病の前状態)」で、このマウスは空腹時の血糖値は正常だが、糖質を摂取した後の血糖上昇が亢進しており、これは実際の患者における糖尿病の症状の起こり始めと酷似したものであったという。このマウスの膵臓を観察してみたところ、生き残ったβ細胞のサイズも膵臓のランゲルハンス島も大きくなっており、数が減った分を生き残った細胞が代償していることが示唆された。
2つ目は、「皮膚(表皮、毛包、バルジ)のモザイク様脱落による一過性点状皮膚病変と恒久的脱毛」で、マウスの背中の皮膚の一部分にモザイク様細胞死を誘導した。皮膚病変は速やかに治癒したが、毛根由来の毛は治癒しきらずに円形脱毛症様の症状が残り、両者の治癒力(再生能力)の違いが示唆された。
3つ目は、「内耳有毛細胞の部分的脱落による、軽度の恒久的難聴」で、蝸牛有毛細胞の約45%がモザイク様に細胞死を来たし、軽度の難聴になっていたことが確認できたほか、この難聴は軽いにも関わらず恒久的でまったく治癒することがなく、有毛細胞に再生能がないことも確認されたという。
これらの実験から、Mos-iCsp3マウスを用いれば、Creマウスを選んで交配させるだけで、研究対象となる細胞の約半分を、簡便に、安定してモザイク様に脱落させる動物実験モデルを構築し得ることが示された。また今回の異なる臓器間の細胞死の比較を通して、少ない量の細胞が脱落した「病気の起きはじめ」においては、細胞死に加え各々の組織、細胞の治癒力(再生能力)が病気の予後に影響を与えることが示唆され、「早期発見・早期治療」において内因性の再生能力を高めることの重要性が改めて示唆された結果となった。
そのため、研究グループでは、今後、同モデルを用いて「病気の起きはじめ」に限り生じる生命現象を詳細に調べることで、「早期発見・早期治療」に向けた新たなコンセプトの治療法や治療薬を探索する研究への展開が期待できるようになるとしている。