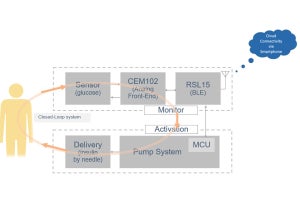
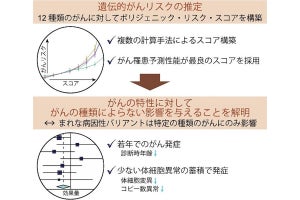
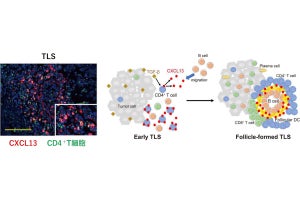
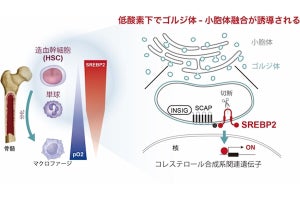
一方で、GATAファミリーの転写因子「GATA6」の発現量は、正常由来組織と比較して前がん病変と浸潤がんで低下しており、同因子によって転写されるタンパク質「DAB2」も同様に発現量が低下していた。そして解析により、GATA6遺伝子とDAB2遺伝子では、H3K27acのヒストン修飾の低下によってタンパク質発現量が低下していることが判明。DAB2遺伝子は卵巣がんのがん抑制遺伝子であり、がん促進的なRASシグナルを抑制する因子であるため、GATA6-DAB2経路が不活性化することによってRASシグナルが活性化することが、卵巣がんの発がんに寄与していると考えられるとしている。
-
GATAファミリーのGATA6とその転写産物DAB2の発現解析。(a)免疫組織化学染色後の卵管組織および前がん病変(卵管上皮内がん)組織(上段)、浸潤がん(高異型度漿液性卵巣がん)組織(下段)の顕微鏡画像。(b)エンハンサーを示すH3K27acのヒストン修飾が、ChIP-seq解析で描出された。患者由来卵巣がん細胞株では、GATA6の転写開始点近傍でエンハンサー活性が低下している。(出所:国がんWebサイト)
RASシグナルの活性化は、上皮細胞が形質転換して浸潤能・転移能を獲得する機構である上皮間葉転換に関わっており、重要な発がんメカニズムの1つとされる。そして今回の解析データも、卵巣がんの発がん早期の段階で上皮間葉転換が生じていることを強く示唆していたという。
そこで研究チームは、上皮間葉転換に重要な「カドヘリン遺伝子」を多く含む16番染色体のカドヘリンクラスター領域のH3K27acを確認。するとHGSOCでは、コピー数減少に加え、広範囲にわたりH3K27acのヒストン修飾が低下していたとする。これらの結果は、HGSOCの発がん早期に、エピゲノム異常を介したAP-1とGATAの両ファミリーの発現異常によって、上皮間葉転換が生じることを示唆するとしている。
-
16番染色体カドヘリンクラスター近傍のゲノム・エピゲノム解析。(a)16番染色体カドヘリンクラスター近傍のゲノムが可視化されたもの。(b)高異型度漿液性卵巣がん(HGSOC)検体において、16番染色体のカドヘリン遺伝子(CDH8、CDH11、CDH5、CDH3、CDH13)やMAF遺伝子は頻繁にコピー数減少を受ける傾向にある(水色と青の部分)。(出所:国がんWebサイト)
続いてこのエピゲノム異常の治療法を探索するため、RASシグナルの阻害剤であるMEK阻害剤を投与した発がんモデル細胞が解析された。すると、腫瘍形成能を持つ発がんモデル細胞において、上皮間葉転換に関わる「CDH1遺伝子」の発現量が回復し、JUN遺伝子に拮抗的に作用する「MAF遺伝子」に加え、GATA6遺伝子とDAB2遺伝子の発現量が上昇した。これらの結果は、MEK阻害剤を用いてRASシグナルを抑制することで、HGSOCのエピゲノム異常を修復できることを示しており、がんエピゲノムを標的とした新しい治療法の開発に貢献する知見だとする。
研究チームは今後、MEK阻害剤を使用した個別化医療や、エピゲノム異常を標的とした新しい治療薬の開発を通じて、予後不良なHGSOCに対する有効な治療法の開発に結び付くことが期待できるとしている。