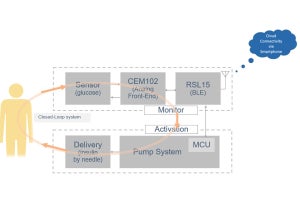
次に、各疾患患者群の血清から増幅されたα-SN凝集体を電子顕微鏡で観察したところ、PDでは2本の細い線維がねじれた構造を、DLBでは数本の線維が複雑にねじれた構造を、またMSAでは太い線維がねじれる、または直線的な構造を示しており、疾患ごとの構造の違いが判明した。
次に、α-シヌクレイノパチー患者血清から増幅したα-SN凝集体が、鋳型としてどのような性質を有するのか、培養細胞を用いた検討が行われた。増幅したα-SN凝集体を、GFP結合A53T変異型α-SNを安定発現させたHEK293T細胞に導入し、細胞内に形成された凝集体を観察したところ、密度が低い紐型、高密度型、線維が絡み合いやや密度が低い中密度型と、3つの異なった構造が観察され、各疾患で形成される凝集体の割合が異なることが見出された。このことから、形成された凝集体の形状観察により、α-シヌクレイノパチー中での疾患の鑑別も可能なことが確かめられた。
また、患者血清由来のα-SNシードを野生型マウスの線条体に投与し、α-SNシードの伝播と凝集についての観察が行われた。PD患者由来の場合は、投与後3か月~1年後にかけて、徐々に病理的に異常なリン酸化α-SNの凝集体が確認されたという。一方で、MSA患者由来の場合は、6か月時点でPD患者由来よりも多くリン酸化凝集体が蓄積していた。さらにMSA患者由来では、投与1年後にはリン酸化α-SNの凝集体は減少し、オリゴデンドロサイトの顕著な脱落が観察され、患者脳で見られる病理と類似していたとする。以上のことから、患者血清由来のα-SNシードは、各α-シヌクレイノパチーの病態を形成する性質を有していることが示唆されたという。
研究チームは今後、疾患ごとに異なるα-SNシードの構造の違いを利用し、血液を用いた簡便かつ有用な診断方法を確立することを目指すとする。さらに、疾患ごとに凝集体の構造が異なる理由を解明することで、病態解明や疾患修飾療法開発への端緒になることも期待できるとしている。