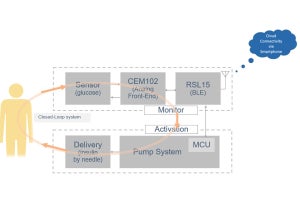
今回の研究では、細胞内活動の主要なエネルギー源として重要なグルコースの吸収が着目された。そして、動物の腸細胞上におけるグルコーストランスポーターによるグルコースの細胞内への輸送について、細胞・組織スケールの可視化計測法が構築され、腸におけるグルコース吸収の時系列計測が実施されることとなった。
具体的には、蛍光色素で標識されたグルコースを用いて大腸菌が培養され、大腸菌内に蛍光グルコースを包含させた蛍光大腸菌を作成。その大腸菌をエサとして線虫に与えることで、腸におけるグルコース吸収の可視化実験が行われた。
捕食開始後、蛍光大腸菌が口部で咀嚼され、破砕された大腸菌内部の蛍光グルコースが咽頭部より腸へと輸送され、腸内において蛍光グルコースが徐々に蓄積する様子を生きたまま可視化するライブイメージングに成功したという。
さらに、腸の活性が通常と不活性のとき、また便秘のときの腸における糖質の吸収を比較するため、野生株に加え、3種類のDMP欠損突然変異株の線虫を用意。DMPは、後体幹筋収縮、前体幹筋収縮、排出筋収縮の3つの異なる運動ステップによって行われる排便運動のことで、腸におけるグルコース吸収の計測と腸内における流速計測が行われ、腸内の流動と腸壁からのグルコース吸収についての実験的調査が行われた。
その結果、エサの摂取量には株による差は見られなかったものの、どの変異株も野生株よりもグルコース吸収が低下していたことが判明したほか、DMPによって生じた順行性および逆行性の蠕動運動による腸内の流速も、変異株は野生株よりも減少していることが確認されたという。このことは、腸内の流動がグルコース吸収量に寄与することを示唆するものだと研究チームでは説明している。
-
(上)蛍光グルコース含有大腸菌を用いた線虫腸内のグルコース吸収の可視化計測。(下)蠕動運動・排便に欠損を持つ線虫変異株の腸におけるグルコース吸収と腸内における腸内流速との比較 (出所:東北大プレスリリースPDF)
また、流体力学に基づく腸内のグルコースの輸送と腸壁における吸収についての理論解析が行われたところ、流体力学ではよく知られたテイラー分散(流れが一様ではなく流れの差が生じる場合の物質の広がる現象)によって腸内でグルコースが撹拌され、腸壁でのグルコース吸収を助長していることが発見されたとする。
なお、今回の研究成果について研究チームでは、腸における栄養吸収や腸内環境の変化について、これまでの生理学的・薬理学的知見に加え、新たに力学的な見解に基づく栄養吸収メカニズムの可能性を示唆するものだと説明しており、今後、腸の活性・疾患、腸内細菌に関係する肥満や糖尿病などにおける栄養吸収や消化、腸内における物質代謝など未知の生理現象について、力学的知見に基づくメカニズムの解明に貢献すると考えられるとしている。