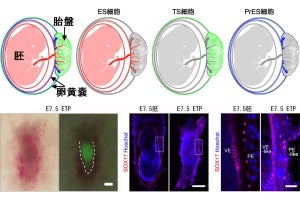
その結果、着床前の胎児細胞に相当するナイーブ型ES細胞は、TS細胞へ分化転換したのに対して、着床後の胎児細胞に相当するプライム型ES細胞から分化転換した細胞は、TS細胞としての性質を保持していないことが判明。
遺伝子発現やDNAメチル化状態を網羅的に解析したところ、これらの細胞間では、「C19MC遺伝子」の発現に顕著な違いがあることが判明したという。C19MC遺伝子は、TS細胞やナイーブ型ES細胞で高発現し、プライム型ES細胞では1/100倍の低発現が示されたとする。
また、ゲノム編集技術を用いてC19MC遺伝子近傍のDNAメチル化領域の欠損TS細胞を作製したところ、C19MC遺伝子がエピジェネティックな制御を受け、DNAメチル化によりその発現が低下することが判明したとする。
なお、C19MC遺伝子は、霊長類だけが持つ遺伝子で、ゲノムインプリンティングを受ける遺伝子座に存在する。つまり、胎児と胎盤組織におけるインプリンティング制御の違いが、細胞の運命決定に関与する可能性が示唆されたと研究チームでは説明している。
そのため、今回の成果については、ヒト受精卵や胎盤の発生メカニズムの基礎的研究に留まらず、生殖補助医療や再生医療への貢献が期待できるとしている。